Способы защиты металла от коррозии и появления ржавчины
Коррозия металлов
Коррозия – разрушение поверхности сталей и сплавов под воздействием различных физико-химических факторов – наносит огромный ущерб деталям и металлоконструкциям. Ежегодно этот невидимый враг «съедает» около 13 млн. т металла. Для сравнения – металлургическая промышленность стран Евросоюза в прошлом, 2014 году произвела всего на 0,5 млн. тонн больше. И это только – прямые потери. А длительная эксплуатация стальных изделий без их эффективной защиты от коррозии вообще невозможна.
Что такое коррозия и её разновидности
Основной причиной интенсивного окисления поверхности металлов (что и является основной причиной коррозии) являются:
- Повышенная влажность окружающей среды.
- Наличие блуждающих токов.
- Неблагоприятный состав атмосферы.
Соответственно этому различают химическую, трибохимическую и электрохимическую природу коррозии. Именно они в совокупности своего влияния и разрушают основную массу металла.
Химическая коррозия
Такой вид коррозии обусловлен активным окислением поверхности металла во влажной среде. Безусловным лидером тут является сталь (исключая нержавеющую). Железо, являясь основным компонентом стали, при взаимодействии с кислородом образует три вида окислов: FeO, Fe2O3 и Fe3O4. Основная неприятность заключается в том, что определённому диапазону внешних температур соответствует свой окисел, поэтому практическая защита стали от коррозии наблюдается только при температурах выше 10000С, когда толстая плёнка высокотемпературного оксида FeO сама начинает предохранять металл от последующего образования ржавчины. Это процесс называется воронением, и активно применяется в технике для защиты поверхности стальных изделий. Но это – частный случай, и таким способом активно защищать металл от коррозии в большинстве случаев невозможно.

Химическая коррозия активизируется при повышенных температурах. Склонность металлов к химическому окислению определяется значением их кислородного потенциала – способности к участию в окислительно-восстановительных реакциях. Сталь – ещё не самый худший вариант: интенсивнее её окисляются, в частности, свинец, кобальт, никель.
Электрохимическая коррозия
Эта разновидность коррозии более коварна: разрушение металла в данном случае происходит при совокупном влиянии воды и почвы на стальную поверхность (например, подземных трубопроводов). Влажный грунт, являясь слабощёлочной средой, способствует образованию и перемещению в почве блуждающих электрических токов. Они являются следствием ионизации частиц металла в кислородсодержащей среде, и инициирует перенос катионов металла с поверхности вовне. Борьба с такой коррозией усложняется труднодоступностью диагностирования состояния грунта в месте прокладки стальной коммуникации.
Электрохимическая коррозия возникает при окислении контактных устройств линий электропередач при увеличении зазоров между элементами электрической цепи. Помимо их разрушения, в данном случае резко увеличивается энергопотребление устройств.
Трибохимическая коррозия
Данному виду подвержены металлообрабатывающие инструменты, которые работают в режимах повышенных температур и давлений. Антикоррозионное покрытие резцов, пуансонов, фильер и пр. невозможно, поскольку от детали требуется высокая поверхностная твёрдость. Между тем, при скоростном резании, холодном прессовании и других энергоёмких процессах обработки металлов начинают происходить механохимические реакции, интенсивность которых возрастает с увеличением температуры на контактной поверхности «инструмент-заготовка». Образующаяся при этом окись железа Fe2O3 отличается повышенной твёрдостью, и поэтому начинает интенсивно разрушать поверхность инструмента.

Методы борьбы с коррозией
Выбор подходящего способа защиты поверхности от образования ржавчины определяется условиями, в которых работает данная деталь или конструкция. Наиболее эффективны следующие методы:
- Нанесение поверхностных атмосферостойких покрытий;
- Поверхностная металлизация;
- Легирование металла элементами, обладающими большей стойкостью к участию в окислительно-восстановительных реакциях;
- Изменение химического состава окружающей среды.
Механические поверхностные покрытия
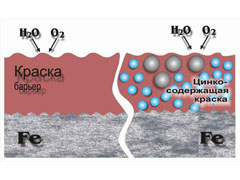
Поверхностная защита металла может быть выполнена его окрашиванием либо нанесением поверхностных плёнок, по своему составу нейтральных к воздействию кислорода. В быту, а также при обработке сравнительно больших площадей (главным образом, подземных трубопроводов) применяется окраска. Среди наиболее стойких красок – эмали и краски, содержащие алюминий. В первом случае эффект достигается перекрытием доступа кислороду к стальной поверхности, а во втором – нанесением алюминия на поверхность, который, являясь химически инертным металлом, предохраняет сталь от коррозионного разрушения.
Положительными особенностями данного способа защиты являются лёгкость его реализации и сравнительно небольшие финансовые затраты, поскольку процесс достаточно просто механизируется. Вместе с тем долговечность такого способа защиты невелика, поскольку, не обладая большой степенью сродства с основным металлом, такие покрытия через некоторое время начинают механически разрушаться.

Химические поверхностные покрытия
Коррозионная защита в данном случае происходит вследствие образования на поверхности обрабатываемого металла химической плёнки, состоящей из компонентов, стойких к воздействию кислорода, давлений, температур и влажности. Например, углеродистые стали обрабатывают фосфатированием. Процесс может выполняться как в холодном, так и в горячем состоянии, и заключается в формировании на поверхности металла слоя из фосфатных солей марганца и цинка. Аналогом фосфатированию выступает оксалатирование – процесс обработки металла солями щавелевой кислоты. Применением именно таких технологий повышают стойкость металлов от трибохимической коррозии.
Недостатком данных методов является трудоёмкость и сложность их применения, требующая наличия специального оборудования. Кроме того, конечная поверхность изменяет свой цвет, что не всегда приемлемо по эстетическим соображениям.
Легирование и металлизация
В отличие от предыдущих способов, здесь конечным результатом является образование слоя металла, химически инертного к воздействию кислорода. К числу таких металлов относятся те, которые на линии кислородной активности находятся возможно дальше от водорода. По мере возрастания эффективности этот ряд выглядит так: хром→медь→цинк→серебро→алюминий→платина. Различие в технологиях получения таких антикоррозионных слоёв состоит в способе их нанесения. При металлизации на поверхность направляется ионизированный дуговой поток мелкодисперсного напыляемого металла, а легирование реализуется в процессе выплавки металла, как следствие протекания металлургических реакций между основным металлом и вводимыми легирующими добавками.

Изменение состава окружающей среды
В некоторых случаях существенного снижения коррозии удаётся добиться изменением состава атмосферы, в которой работает защищаемая металлоконструкция. Это может быть вакуумирование (для сравнительно небольших объектов), или работа в среде инертных газов (аргон, неон, ксенон). Данный метод весьма эффективен, однако требует дополнительного оборудования — защитных камер, костюмов для обслуживающего персонала и т.д. Используется он главным образом, в научно-исследовательских лабораториях и опытных производствах, где специально поддерживается необходимый микроклимат.
Кто нам мешает, тот нам поможет
В завершение укажем и на довольно необычный способ коррозионной защиты: с помощью самих окислов железа, точнее, одного из них — закиси-окиси Fe3O4. Данное вещество образуется при температурах 250…5000С и по своим механическим свойствам представляет собой высоковязкую технологическую смазку. Присутствуя на поверхности заготовки, Fe3O4 перекрывает доступ кислороду воздуха при полугорячей деформации металлов и сплавов, и тем самым блокирует процесс зарождения трибохимической коррозии. Это явление используется при скоростной высадке труднодеформируемых металлов и сплавов. Эффективность данного способа обусловлена тем, что при каждом технологическом цикле контактные поверхности обновляются, а потому стабильность процесса регулируется автоматически.
Способы защиты металла от коррозии и появления ржавчины
Интенсивное развитие производства стали, как правило, предполагает поиск новых средств и способов, которые позволяли бы предотвращать разрушение изделий из металла. Создание инновационных методик, связанных с защитой от коррозии, — это постоянный процесс. Изделия, сделанные практически из любого металла, могут терять свою работоспособность из-за воздействия химических и физических факторов извне. Последствия этого можно увидеть в виде ржавчины.

Разновидности коррозии
Перед тем как защитить металл от ржавчины, следует узнать о существующих видах. Способ обеспечения антикоррозийной защиты находится в прямой зависимости от условий применения деталей. Потому принято выделять следующие типы:
- коррозия, которая связана с явлениями атмосферного характера;
- разрушение структуры металла в воде из-за наличия в ней солей и бактерий;
- деструктивные процессы, происходящие в грунте (почвенная коррозия).
Способы антикоррозионной защиты при этом должны подбираться в индивидуальном порядке, руководствуясь тем, в каких условиях будет эксплуатироваться изделие из металла.
Что касается типов поражения конструкций, то они могут быть следующими:
- ржавчина находится на всей поверхности изделия отдельными участками или сплошным покрытием;
- имеет вид пятен и проникает вглубь элемента;
- разрушает молекулы металла, приводя к трещинам;
- масштабное ржавление, при котором разрушается не только поверхность, но и более глубокие слои.
 Типы разрушения бывают и комбинированными. В некоторых ситуациях их очень сложно определить на глаз, особенно при точечном ржавлении.
Типы разрушения бывают и комбинированными. В некоторых ситуациях их очень сложно определить на глаз, особенно при точечном ржавлении.
Принято выделять химическую коррозию. При контакте с нефтяными продуктами, спиртами и иными агрессивными веществам происходит особая реакция, которая сопровождается высокой температурой и выделениями газа.
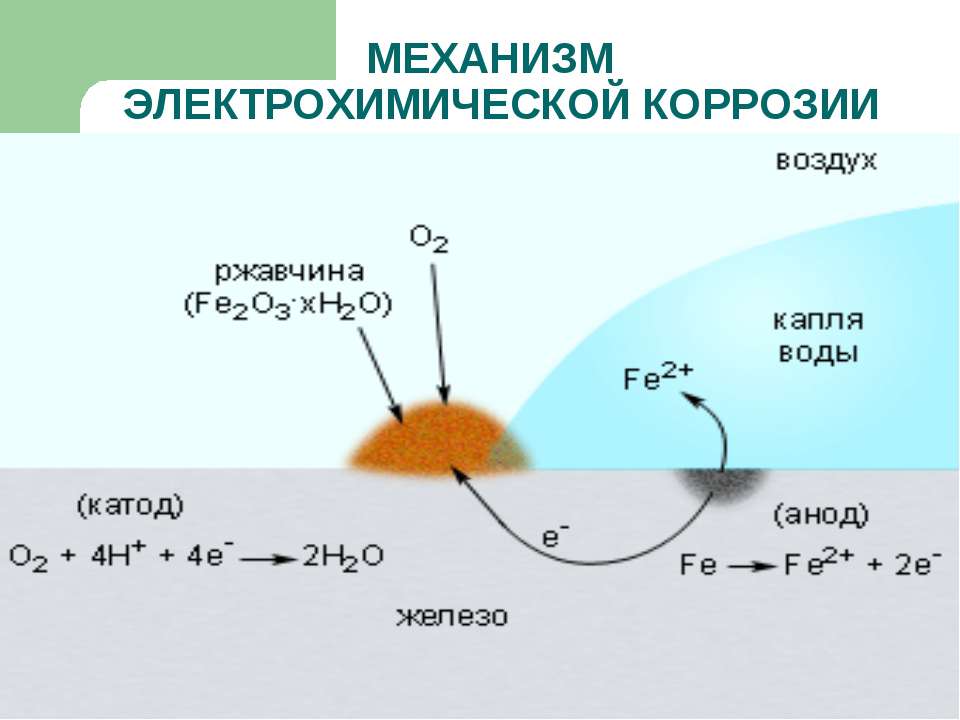
При электрохимической коррозии поверхность металлического сплава соприкасается с водой (электролитом). При этом осуществляется диффузия материала. Электролит обуславливает появление электротока, а электроны металла замещаются и приходят в движение, в результате чего возникает ржавчина.
Обеспечение защиты от коррозии и выплавка стальных изделий — две взаимосвязанные вещи. Коррозия причиняет существенный ущерб постройкам хозяйственного или промышленного назначения. Кроме того, этот процесс может привести к катастрофе, если говорить, например, об опорах электропередач, мостах, заграждениях и т. д.
Защита от коррозии в промышленности и быту
Необходимо обеспечить металлу надежную защиту от коррозии. Все условия, когда требуется защита металлов от коррозии, кратко можно поделить на промышленные и бытовые.
В промышленности существует несколько вариантов антикоррозийной защиты:
 Пассивация. В процессе производства в сталь добавляются другие металлические сплавы (молибден, никель, ниобий). Эти материалы характеризуются отличными эксплуатационными свойствами и высокой стойкостью к агрессивным воздействиям. Эти разновидности стали принято называть легированными.
Пассивация. В процессе производства в сталь добавляются другие металлические сплавы (молибден, никель, ниобий). Эти материалы характеризуются отличными эксплуатационными свойствами и высокой стойкостью к агрессивным воздействиям. Эти разновидности стали принято называть легированными.- Нанесение на поверхность стали каких-то других металлов. При этом на изделии образуется защитное покрытие. Зачастую для данной цели применяется алюминий, кобальт и хром.
- Применение специальных протекторов и анодов. При контакте детали с водой происходит разрушение протектора, который образует защитное покрытие. Такая методика часто используется в производстве деталей для морских буровых установок и судов.
Промышленные способы обеспечения антикоррозийной защиты очень разнообразны. К ним относится и покрытие специальной стекловолоконной эмалью, и химическая защита, и многие другие.
Антикоррозийная защита материала в домашних условиях подразумевает применение ЛКМ-покрытий и химических средств. Свойства защитного плана обеспечивают сочетанием разных элементов: смол на основе силикона, ингибиторов, полимеров, металлической стружки и пудры.
Следует отметить, что перед окрашиванием детали, ее нужно обработать специальным преобразователем коррозии или грунтовкой, иначе ее эксплуатационные свойства будут быстро уменьшаться.
Сегодня в продаже встречается несколько разновидностей преобразователей ржавчины:
- Средства-грунтовки. Характеризуются высокой адгезией с металлическими поверхностями, способствуют выравниванию покрытия перед покраской. Во многих грунтовках содержатся ингибиторы, тормозящие коррозийные процессы. Кроме того, заблаговременное нанесение слоя грунтовки позволяет сэкономить на окрашивании.
- Химические препараты. Преобразуют окись железа в более безопасные вещества, которым не страшна коррозия. Такие средства называются стабилизаторами.
- Составы, преобразующие ржавчину в обычные соли.
- Масла и смолы, уплотняющие и связывающие ржавчину, обеспечивая ее нейтрализацию.
Специалисты советуют подбирать краску и грунтовку какого-то одного производителя, чтобы их химический состав не имел особых отличий.
Краски для покрытия металлических изделий
Краски, предназначенные для обработки металлических поверхностей, бывают обычными и термостойкими. В большинстве случаев применяются три типа составов: эпоксидные, акриловые и алкидные. Есть и специальные краски антикоррозийного типа, которые обладают следующими достоинствами:
- эффективно защищают покрытие от атмосферных воздействий и перепадов температур;
- с легкостью наносятся валиком, кисточкой или распылителем;
- многие из них являются быстросохнущими;
- обладают широким выбором расцветок;
- отличаются долговечностью.
Что касается самых недорогих и доступных средств, то тут следует обратить внимание на обыкновенную серебрянку. В составе этого покрытия есть алюминиевая пудра, образующая защитную пленку на обработанном им изделии.
Этапы работ по борьбе с коррозией в быту
Методы борьбы с коррозией металлов предполагают определенную последовательность. Следует перечислить основные этапы этой работы:
 Перед тем как наносить преобразователь или грунтовую смесь, поверхность необходимо полностью очистить от маслянистых пятен, следов коррозии и различного рода загрязнений. Для этих мер можно воспользоваться болгаркой или щетками с металлическим ворсом.
Перед тем как наносить преобразователь или грунтовую смесь, поверхность необходимо полностью очистить от маслянистых пятен, следов коррозии и различного рода загрязнений. Для этих мер можно воспользоваться болгаркой или щетками с металлическим ворсом.- После этого можно приступать к нанесению слоя грунтовки, которая затем должна впитаться и как следует просохнуть.
- Далее на поверхность наносится пара слоев. Перед тем как наносить второй слой, нужно дождаться полного высыхания первого. В процессе работы обязательно нужно пользоваться защитными очками, перчатками и специальным респиратором, так как все применяемые вещества и составы являются токсичными.
Антикоррозийная защита металлических сплавов — очень непростой процесс. В промышленности он начинается на стадии расплавления стали. Производители ЛКМ-покрытий занимаются совершенствованием своей продукции, увеличивая ее долговечность и стойкость.
Лада 21099 Nasty Girl › Бортжурнал › Как правильно бороться с очагами коррозии. Варианты.

Давно хотел рассказать о способах борьбы с ржавчиной, но все время оставлял текст в черновиках из-за того что про ржавчину не могу писать красиво. Ржавчина — это враг металлов, и тяжело кучу информации про нее слить в единый опус, да еще интересный для прочтения. Но попробуем сделать это, разбавив текст картинками.
Что такое коррозия — википедия кратко сообщает что это разрушение металла при взаимодействии с окружающей средой. Другими словами окисление при взаимодействии с влагой и кислородом. Чтобы это окисление не происходило, или как можно дольше не начиналось — снаружи металл покрывают краской, а внутри антикоррозийными средствами. Там где плохо подготовлено, плохо обработано или плохо окрашено — там всегда вылезет ржавчина, это вопрос времени. Зарубежные источники часто ржавчину сравнивают с грибком, на теле человека, что если она появилась, то можно залечить, но не искоренить полностью. Давайте еще раз повторим и запомним, если есть коррозия — то что с ней не делай, она всегда вылезет, это вопрос лишь времени и качества подготовки, но она всегда вылезет снова. Но какие варианты есть для предотвращения или замедления развития коррозии? К сожалению их всего три:
1 способ — это радикальный и небюджетный, замена детали целиком. Это хороший вариант, но он не всегда возможен и оправдан, так как дверь или переднее крыло заменить легко, а арку колеса или часть стойки — гораздо сложнее. Придется пользоваться сварочным аппаратом и режуще-зачистным инструментом.

2 способ — это пескоструй. Если нет возможности или желания менять кузовную деталь, то можно воспользоваться пескоструем. Как понятно из названия (песок и струя), это прибор, агрегат, как удобнее, из которого под давлением вместе с воздухом вылетают песчаные крупинки, они бьются о поверхность и вычищают металл до бела, все поры и очаги коррозии улетают на глазах. Лучше пескоструя пока не придумали способа избавиться от коррозии. Услуги пескоструя всегда востребованы и относительно дороги, но результат всегда оправдывает затраченные средства.
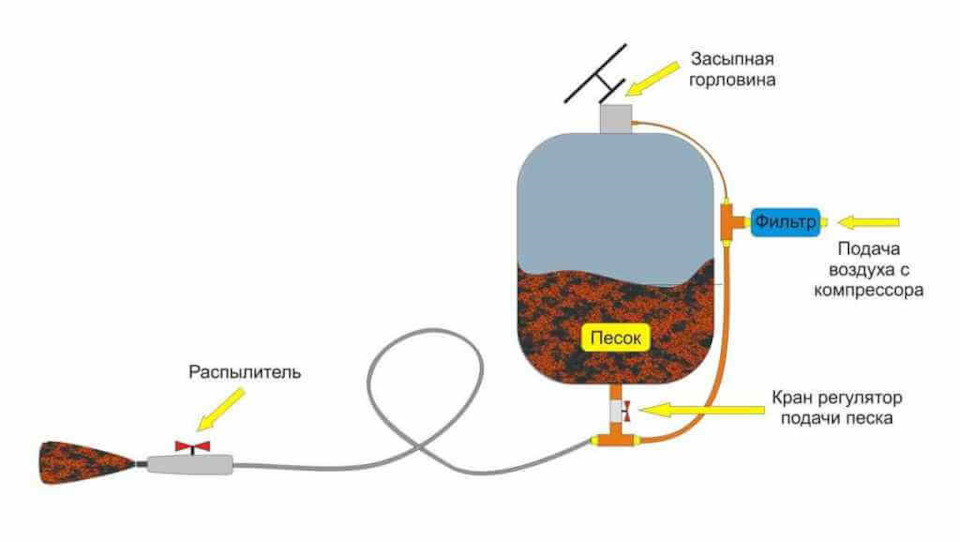
3 способ — это химический, я бы так назвал или универсальный. При таком способе все поры коррозии никогда не будут полностью удалены, но благодаря современной химии можно замедлить окисление металла.
Химический способ удаления коррозии делится на 3 этапа:
— для начала необходимо обработать коррозию механическим путем. Это можно делать зачистным или коралловым кругом на болгарку, можно по старинке наждачкой на бруске, в общем на этом этапе необходимо зачистить металл максимально тщательно, чтобы полностью увидеть масштаб очага коррозии. Ниже на фото показана дверь после зачистки болгаркой:

— после механического верхнего слоя ржавчины, мы увидим примерно такую картинку, как показано ниже:


Эти образцы отлично справляются со своими обязанностями. Применение простое — нанесли средство на коррозию, подождали согласно инструкции, вытерли и смотрим, если есть черные поры — их шилом или чем-то тонким и прочным расковыриваем, чтобы открыть пору и снова наносим преобразователь, и так до бесконечности пока металл полностью не станет белым. Сразу запомните, что все поры удалить не получится, и наша задача раскрыть и обработать хотя бы те что заметны глазу.
Вот пример тщательной обработки угла двери Полиформом и последующей зачисткой коралловым кругом:

— после работы преобразователя ржавчины металл становится незащищенным и очень легко начнет снова корродировать, если его сразу не «закрыть». «Закрыть» металл после преобразователя можно опять несколькими способами:
а) Для временного закрытия или консервации металла от коррозии можно использовать средство APP R-Stop. Это средство наносится на металл, и при застывании создает пленку типа суперклея, которая не дает развиваться коррозии некоторое время. Это средство консервант, его применяют в тех случаях, если до покраски еще ждать неделю или месяц, и надо временно остановить ржавчину. Перед нанесением шпаклевки на место, где обработали APP R-Stop`ом, обязательно зачистить максимально тщательно, иначе шпаклевка вздуется! Проверенно на себе!

б) если вы готовитесь к покраске, то на место после преобразователя можно нанести праймер. Для многих читателей это будет новый термин, поэтому опишу что такое праймер и филлер и в чем их отличия:
У большинства мастеров, особенно старой школы, под словом грунтовка по умолчанию подразумевается акриловый грунт. На самом деле это лишь от части правильно. Грунт разделяют на 2 категории, первичная и вторичная
Так вот праймер — это первичный этап для грунтования поверхности, и именно он необходим для дополнительной изоляции металла от возможной коррозии, для улучшения адгезии (сцепных свойств) последующих материалов. Праймер бывает эпоксидный и кислотный/фосфатирующий. Поэтому если у вас новый неокрашенный элемент кузова, или участок где есть голый металл, например после преобразователя ржавчины — то его необходимо вскрыть праймером, т.е. либо кислотным либо эпоксидным грунтом.
Вторичными грунтами называются филлеры. Их задача не бороться с коррозией, их задача заполнять поры и риски после обработки металла перед покраской. Так вот акриловый грунт и есть филлер. Акриловый грунт можно наносить на старую краску, но на голый металл можно наносить лишь в том случае, когда он здоров и нет абсолютно никаких очагов коррозии или остатков. Если ваш мастер на участок где была коррозия, наносит акриловый грунт — будьте готовы к тому, что в том месте вылезет ржавчина.
Продолжим пункт б). После обработки металла наносим праймер — кислотный грунт, он умеет бороться с коррозией, не давать ей развиваться. В основе кислотного грунта состоит фосфорная кислота, которая и образует прочную пленку, которая повышает адгезию металла, борется и затрудняет развитие коррозии. После высыхания кислотника можно наносить сверху акриловый грунт и красить. Неудобство заключается в том, что на кислотный грунт нельзя наносить шпаклевку, а наоборот можно. Поэтому кислотный праймер/грунт наносится только на ровные детали, которые не нуждаются в доводке. Так же кислотник нельзя покрывать эпоксидным грунтом, т.к. они вступают в реакцию сами с собой, покрывать сверху только акриловым грунтом.

в) если вы готовитесь к покраске, то на место после преобразователя можно нанести праймер — эпоксидный грунт. Особенность его в том, что он не борется со ржавчиной, а создает очень прочное защитное покрытие, которое не даст коррозии прорываться наружу, или задержит ее. Кто пользовался эпоксидным клеем — сразу поймет принцип этого праймера. При застывании полиэфирные смолы становятся прочными и прекрасно изолируют металл. Пленка становится крепкой, не боится механических повреждений и не пористая, а значит не боится воды и влаги. Эпоксидный грунт не борется с коррозией, он только защищает металл снаружи от попадания влаги, поэтому наносить эпоксидный грунт необходимо на здоровый или уже вылеченный металл.
Эпоксидным грунтом чаще всего вскрывают наружные элементы, которые подвержены механическим нагрузкам, например пороги и днище автомобиля.

г) если вы готовитесь к покраске, то на место после преобразователя можно нанести шпаклевку. Шпаклевку можно отнести уже больше к подготовительному материалу, нежели чем антикоррозийное средство. Так же многие будут утверждать, что шпаклевка это пористый материал, и его нельзя держать открытым — и здесь они будут правы. В воздухе есть определенное количество влаги, и если шпаклевку нанести на длительный срок, то она напитает влагу и в месте, где вы тщательно удаляли коррозию — она снова появится. По технологии шпаклевку можно наносить как на голый металл, если он здоров. На больной металл или с прошлыми очагами коррозии шпаклевка наносится только на эпоксидный грунт. При нанесении на эпоксидный грунт у вас будет дополнительный слой защиты от коррозии.

Когда мы ознакомились с теорией, давайте кратко подведем итоги:
1) Если у нас были или есть очаги коррозии и необходимо выводить шпаклевкой плоскость, то чтобы правильно изолировать металл от окисления, можно поступить так:
а) преобразователь ржавчины -> шпаклевка -> акриловый грунт -> ЛКП (это базовый набор)
б) преобразователь ржавчины -> эпоксидный грунт в местах коррозии -> шпаклевка -> акриловый грунт -> ЛКП (этот набор гораздо лучше и прочнее создаст защитную пленку).
2) Если у нас были очаги коррозии или частично присутствуют, и нет необходимости наносить шпаклевку, то можно поступить так:
а) преобразователь ржавчины -> кислотный грунт -> акриловый грунт -> ЛКП.
В зависимости от вашего случая вы можете выбирать как поступить, какую химию приобретать. Так же все зависит от желаемой цены ремонта. Когда в приоритете бюджетный ремонт — то и выбор материала будет соответствующим, как и результат. В покраске автомобиля важна подготовительная часть, чтобы нейтрализовать все очаги коррозии, тщательно закрыть голый металл грунтом, и лишь потом наносить ЛКП. В этом случае покрашенный автомобиль будет долго не окисляться и не ржаветь.
Большое спасибо за прочтение!
Всех благ!
Как защитить металл от коррозии в домашних условиях
Минувший век характеризуется возникновением огромного количества принципиально новых материалов, нашедших широкое применение в разнообразнейших отраслях человеческой жизнедеятельности, включая и строительную. Собственно говоря, в материаловедении произошла подлинная революция, причем значительное внимание было уделено вопросам предотвращения коррозии металлов и разработке материалов, необходимых для достижения этой цели. Так, например, появились различные композитные панели, гальванические покрытия, облицовочные материалы из строительной керамики (керамогранит, облицовочный кирпич и т. д.), прочие современные строительные материалы, не нуждающиеся в защите путем дополнительной обработки.
Применение в строительстве металлических изделий, как и прежде, остается востребованным чрезвычайно широко. Перила, декоративные решетки и ограждения даже сегодня чаще всего изготавливают из металлов, которые подвержены коррозии. Так, отделка фасадов, которую в наше время осуществляют посредством использования тех или иных материалов, устойчивых к воздействию атмосферной влаги, все же не обходится без применения крепежа, узлов ввода-вывода коммуникаций, иных скрытых элементов. Данные компоненты наиболее часто выполняются из металла, а потому жизненно нуждаются в антикоррозионной защите.
Хорошо известно, что основной причиной коррозии является вода, которая неминуемо попадает на металлические поверхности даже в помещениях. А потому наиболее эффективным и, пожалуй, единственным способом защиты металлов, подверженных коррозии, является нанесение изолирующих составов и химических покрытий.
К традиционным способам предохранения металлических изделий от коррозии относится механическая зачистка старой ржавчины, а также нанесение преобразователей ржавчины, позволяющих удалить ее остатки, после чего поверхность металла покрывается грунтом и лакокрасочным защитным слоем.
Некоторые из производителей лакокрасочных материалов рекомендуют осуществить завершение этого процесса путем нанесения поверх слоя краски специального защитного состава. При этом основное внимание необходимо обратить на то, чтобы грунтовки, краски и лаки были качественными. На упаковках с грунтами указываются виды специальных добавок, улучшающих свойства состава: изолирующих, фосфатирующих, пассивирующих и протектирующих.
Как видим, окраска металлических поверхностей «по старинке» — процесс достаточно сложный и трудоемкий, отнимающий много сил и времени. Ныне компании-производители рекомендуют разработанные ими антикоррозионные составы, отличающиеся большей универсальностью, применение которых позволяет одновременно решать не какую-либо одну, а сразу несколько задач. Наиболее популярными среди потребителей являются так называемые средства «два в одном» и «три в одном». Краска «два в одном» сочетает в себе находящиеся в одной емкости грунтующий и окрашивающий составы, при помощи которых возможно выполнение как грунтования, так и окончательной окраски металлических поверхностей.
Нередко производителями подобных красок рекомендуется использование составов типа «два в одном» по предварительно огрунтованным поверхностям, работающим в агрессивных средах, к примеру для кровли.
Композиции «три в одном», кроме грунта и краски, включают в свой состав также и преобразователь ржавчины. Их целесообразно использовать при окрашивании сильно заржавевших поверхностей, при этом необходимо удалить лишь верхний рыхлый слой ржавчины. На упаковках подобных составов обычно можно видеть надпись — непосредственно на ржавчину.
Может ли вода защитить металл от коррозии?
Казалось бы как вообще такое возможно? Этого не может быть, потому что этого быть не может никогда! Однако прогресс не стоит на месте. Он стремительно движется вперед во всех отраслях, в т. ч. и в сфере разработок новых видов лакокрасочных материалов.
Преимущества, которыми обладают лакокрасочные материалы (ЛКМ) на основе водных полимеров, способствуют ежегодному росту их производства и применения. На состоявшейся 3–4 декабря 2013 г. в г. Дюссельдорфе (Германия) конференции European Coatings Conference «Waterborne coatings» были рассмотрены достижения, проблемы и пути их решения в области водных ЛКМ.
Высокое качество водных 2К полиуретановых систем в сочетании с низкой эмиссией растворителей вызывает большой спрос промышленности. Эти материалы успешно зарекомендовали себя во многих сегментах рынка, поскольку они позволяют преодолеть разрыв между растущей потребностью в «зеленых» решениях и требованиями к качеству со стороны промышленности и профессионалов. Поставщики лакокрасочных материалов (ЛКМ) постоянно совершенствуют качество водных систем, а сырьевая отрасль развивает инновационные концепции как для смол, так и для отвердителей.
В докладе д-ра Кристофа Ирла (Christoph Irle), Bayer Material Science (Германия), особое внимание было уделено производству и надежности таких составов. Рассмотрение этих вопросов в дальнейшем поможет получить водные 2К системы, близкие к самой высокой отметке, которая уже многие десятилетия установлена для 2К полиуретановых систем. Продолжил тему полиуретанов д-р Норберт Питшман (Norbert Pietschmann), Institute fur Lack und Fabric (Германия), выступив с докладом «Водные УФ-отверждаемые ЛКМ для защиты стали от коррозии». При испытаниях противокоррозионных свойств пигментов, ингибиторов, связующих или их комбинаций он использовал электрохимические измерения, обеспечивающие более быстрое получение результатов. Этим методом
было установлено, что оптимальная комбинация связующего состоит из смеси УФ-отверждаемых и физически высыхающих дисперсий. Кроме того, был найден подходящий и быстрый способ выбора антикоррозионного пигмента и ингибитора. На основе предварительных исследований могут быть созданы модельные рецептуры с отличной адгезией и коррозионной стойкостью. После нанесения на сталь испарения влаги и УФ-отверждения были испытаны на стойкость к соляному туману и конденсации влаги. Электрохимические исследования подтвердили отличную адгезию и устойчивость к коррозии, однако это было получено только на стальных поверхностях с цинкфосфатным подслоем.
Защита металла от коррозии в домашних условиях
Существуют ли «народные» средства против ржавчины?
И обычное железо, и даже высококачественная сталь во влажном воздухе, который наверняка присутствует в гаражах, сараях и прочих подсобных помещениях подвергаются коррозии — постепенно покрываются буро-коричневой рыхлой пленкой ржавчины. Порой абсолютно новая вещь, случайно оставленная под открытым небом или «забытая» на зиму на даче, покрывается неприятной на вид бурой коростой. Ржавчина, которая состоит из смеси оксида железа Fe2O3 и метагидроксида железа FeO(OH), не защищает его поверхность от дальнейшей «агрессии» со стороны кислорода воздуха и воды, и со временем некогда прочный железный предмет разрушается (очень часто полностью).
Секреты удаления ржавчины есть. Ржавчину проще всего снять обработкой разбавленным водным раствором соляной или серной кислоты, содержащим ингибитор кислотной коррозии уротропин. Ингибиторы (от латинского «ингибео» — останавливаю, сдерживаю) — вещества, тормозящие химическую реакцию (в данном случае реакцию растворения металла в кислоте). Но ингибитор коррозии не мешает взаимодействию кислоты с оксидом и гидроксидом железа, из которых состоит ржавчина.
Если заржавели оконные шпингалеты, мелкие детали велосипеда, болты или гайки, их погружают в 5% раствор кислоты с добавкой 0,5 г уротропина на литр, а на крупные вещи такой раствор наносят кистью.
Использовать растворы сильных кислот без ингибитора рискованно: можно растворить не только ржавчину, но и само изделие, поскольку железо — активный металл и взаимодействует с сильными кислотами с выделением водорода и образованием солей. В качестве ингибитора кислотной коррозии при удалении ржавчины можно использовать и картофельную ботву. Для этого в стеклянную банку кладут свежие или засушенные листья картофеля и заливают 5-7%-й серной или соляной кислотой так, чтобы уровень кислоты был выше примятой ботвы. После 15-20-минутного перемешивания содержимого банки кислоту можно сливать и использовать для обработки ржавых железных изделий.
Преобразователь ржавчины превращает ее в прочное покрытие поверхности коричневого цвета. На изделие кистью или пульверизатором наносят 15-30%-й водный раствор ортофосфорной кислоты и дают изделию высохнуть на воздухе. Еще лучше использовать ортофосфорную кислоту с добавками, например, 4 мл бутилового спирта или 15 г винной кислоты на 1 л раствора ортофосфорной кислоты. Ортофосфорная кислота переводит компоненты ржавчины в ортофосфат железа FePO4 , который создает на поверхности защитную пленку. Одновременно винная кислота связывает часть производных железа в тартратные комплексы.
Металлические поверхности, сильно изъеденные ржавчиной, обрабатывают:
- смесью 50 г молочной кислоты и 100 мл вазелинового масла. Кислота превращает метагидроксид железа из ржавчины в растворимую в вазелиновом масле соль — лактат железа. Очищенную поверхность протирают тряпочкой, смоченной вазелиновым маслом;
- раствором 5 г хлорида цинка и 0,5 г гидротартрата калия в 100 мл воды. Хлорид цинка в водном растворе подвергается гидролизу и создает кислую среду. Метагидроксид железа растворяется за счет образования в кислой среде растворимых комплексов железа с тартрат-ионами;
Отворачивать приржавевшие гайки помогает смачивание керосином, скипидаром или олеиновой кислотой. Через некоторое время гайку удается отвернуть. Затем можно поджечь керосин или скипидар, которым ее смачивали. Обычно этого достаточно для разъединения гайки и болта. Самый последний способ: к гайке прикладывают сильно нагретый паяльник. Металл гайки расширяется, и ржавчина отстает от резьбы; теперь в зазор между болтом и гайкой можно впустить несколько капель керосина, скипидара или олеиновой кислоты, и на этот раз гайка отвернется ключом.
Есть и другой способ разъединения ржавых гайки и болта. Вокруг заржавевшей гайки делают «чашечку» из воска или пластилина, бортик которой выше уровня гайки на 3-4 мм. Заливают в чашечку разбавленную серную кислоту и кладут кусочек цинка. Через сутки гайка легко отвернется ключом. Чашечка с кислотой и металлическим цинком на железном основании — это миниатюрный гальванический элемент. Кислота растворяет ржавчину, и образовавшиеся катионы железа восстанавливаются на поверхности цинка; в то же время металл гайки и болта не растворяется в кислоте до тех пор, пока у кислоты есть контакт с цинком, поскольку цинк более активный в химическом отношении металл, чем железо.
Чтобы предохранить от ржавления столярный или слесарный инструмент, его смазывают с помощью кисточки раствором 10 г воска в 20 мл бензина. Воск растворяют в бензине на водяной бане, не используя открытого огня (бензин огнеопасен).
Полированный инструмент защищают, нанося на его поверхность раствор 5 г парафина в 15 мл керосина. А старинный рецепт мази для защиты металла от ржавчины таков: растапливают 100 г свиного жира, добавляют 1,5 г камфоры, снимают с расплава пену и смешивают его с графитом, растертым в порошок, чтобы состав стал черным. Остывшей мазью смазывают инструмент и оставляют его на сутки, а потом полируют металл шерстяной тряпочкой.
Чтобы в будущем не мучиться, отворачивая крепежные изделия с проржавевшей резьбой, ее заранее смазывают смесью вазелина с графитовым порошком. Вместо вазелина можно взять и любую другую жировую смазку нейтрального или слабощелочного типа. Болты и гайки на такой смазке легко отворачиваются даже через несколько лет пребывания под открытым небом.
Способы защиты металла от коррозии и появления ржавчины
КОРРОЗИЯ МЕТАЛЛОВ И СПЛАВОВ
1. Коррозия (от латинского « corrodere » разъедать) – самопроизвольный окислительно-восстановительный процесс разрушения металлов и сплавов вследствие взаимодействия с окружающей средой.
2. Виды коррозии: химическая и электрохимическая
I . Химическая – коррозия, обусловленная взаимодействием металлов с веществами, содержащимися в окружающей среде, при этом происходит окислительно-восстановительное разрушение металла без возникновения электрического тока в системе.
К химической коррозии относятся:
— газовая коррозия — коррозионное разрушение под воздействием газов при высоких температурах;
— коррозия в жидкостях-неэлектролитах.
— химическая коррозия, обусловленная взаимодействием металлов с газами.
Основной окислитель – кислород воздуха.
Процессы химической коррозии железа:
2 Fe + O 2 = 2 FeO
3 Fe + 3 O 2 = FeO · Fe 2 O 3 (смешанный оксид железа ( II , III ) )
4 Fe + 3 O 2 + 6 H 2 O = 4 Fe ( OH )3 (на воздухе в присутствии влаги)
Fe ( OH )3 t ° C → H 2 O + FeOOH (ржавчина)
2 Fe + 3 Cl 2 = 2 FeCl 3
Химическая коррозия в жидкостях-неэлектролитах
Жидкости-неэлектролиты — это жидкие среды, которые не являются проводниками электричества. К ним относятся: органические (бензол, фенол, хлороформ, спирты, керосин, нефть, бензин); неорганического происхождения (жидкий бром, расплавленная сера и т.д.). Чистые неэлектролиты не реагируют с металлами, но с добавлением даже незначительного количества примесей процесс взаимодействия резко ускоряется. Например, если нефть будет содержать серу или серосодержащие соединения (сероводород, меркаптаны) процесс химической коррозии ускоряется. Если вдобавок увеличится температура, в жидкости окажется растворенный кислород — химическая коррозия усилится.
Присутствие в жидкостях-неэлектролитах влаги обеспечивает интенсивное протекание коррозии уже по электрохимическому механизму.
Химическая коррозия в жидкостях-неэлектролитах подразделяется на несколько стадий:
— подход окислителя к поверхности металла;
— хемосорбция реагента на поверхности;
— реакция окислителя с металлом (образование оксидной пленки);
— десорбция оксидов с металлом (может отсутствовать);
— диффузия оксидов в неэлектролит (может отсутствовать).
Для защиты конструкций от химической коррозии в жидкостях-неэлектролитах на ее поверхность наносят покрытия, устойчивые в данной среде.
II . Электрохимическая – окислительно-восстановительное разрушение сплавов и металлов, содержащих примеси, с возникновением электрического тока в системе.
АНОД (более активный металл) – разрушается
КАТОД (менее активный металл или примесь неметалла, способного + ē) – восстанавливается среда
Ме 0 – n ē → Me n + (процесс окисления)
кислая среда: 2 H + + 2ē → H 2 (процесс восстановления)
влажный воздух: O 2 + 2 H 2 O + 4ē → 4 OH — (процесс восстановления)
Электрохимическая коррозия железной детали с примесями меди во влажном воздухе.
А: Fe 0 — 2ē → Fe 2+ (Окисление)
К: O 2 + 2 H 2 O + 4ē → 4 OH — (процесс восстановления)
Итог: 2 Fe + O 2 + 2 H 2 O = 2 Fe ( OH )2 (белая ржавчина)
4 Fe ( OH )2 + 2 H 2 O + O 2 = 4 Fe ( OH )3 (бурая ржавчина)
III . Защита от коррозии:
1). Металлические покрытия – анодное (покрытие более активным металлом Zn , Cr ) – оцинкованное железо; катодное (покрытие менее активным металлом Ni , Sn , Ag , Au ) – белая жесть (лужёное железо) – не защищает от разрушения в случае нарушения покрытия.
2). Неметаллические покрытия – органические (лаки, краски, пластмассы, резина — гумирование, битум);
неорганические (эмали).
3). Протекторная защита – присоединение пластины из более активного металла ( Al , Zn , Mg ) – защита морских судов.
4). Электрохимическая (катодная) защита – соединение защищаемого изделия с катодом внешнего источника тока, вследствие чего изделие становится катодом. Ток идёт в противоположном направлении.
5). Добавление ингибиторов ( в зависимости от природы металла – NaNO 2, Na 3 PO 4, хромат и бихромат калия, ВМС органические соединения), адсорбируются на поверхности металла и переводят его в пассивное состояние.
Задания и вопросы по теме: «Коррозия металлов и сплавов»
№1. При электрохимической коррозии на поверхности анода протекает процесс
А) Восстановления ионов водорода; Б) Окисления металла;
В) Восстановление молекул кислорода; Г) Окисления молекул водорода.
№2. Почему считают, что рядом со стальной коронкой (Fе) не рекомендуется ставить золотую (Аu)?
№3. Вот история, произошедшая с норвежским грузовым судном «Анатина». Трюмы теплохода, направлявшегося к берегам Японии, были заполнены медным концентратом. Корпус судна сделан был из стали. Внезапно судно дало течь. Объясните, что произошло.
№4. Какой из компонентов загрязненного городского воздуха является наиболее коррозионно-активным по отношению к металлам, особенно при повышенной влажности:
а) N2; б) СО; в) SO2.
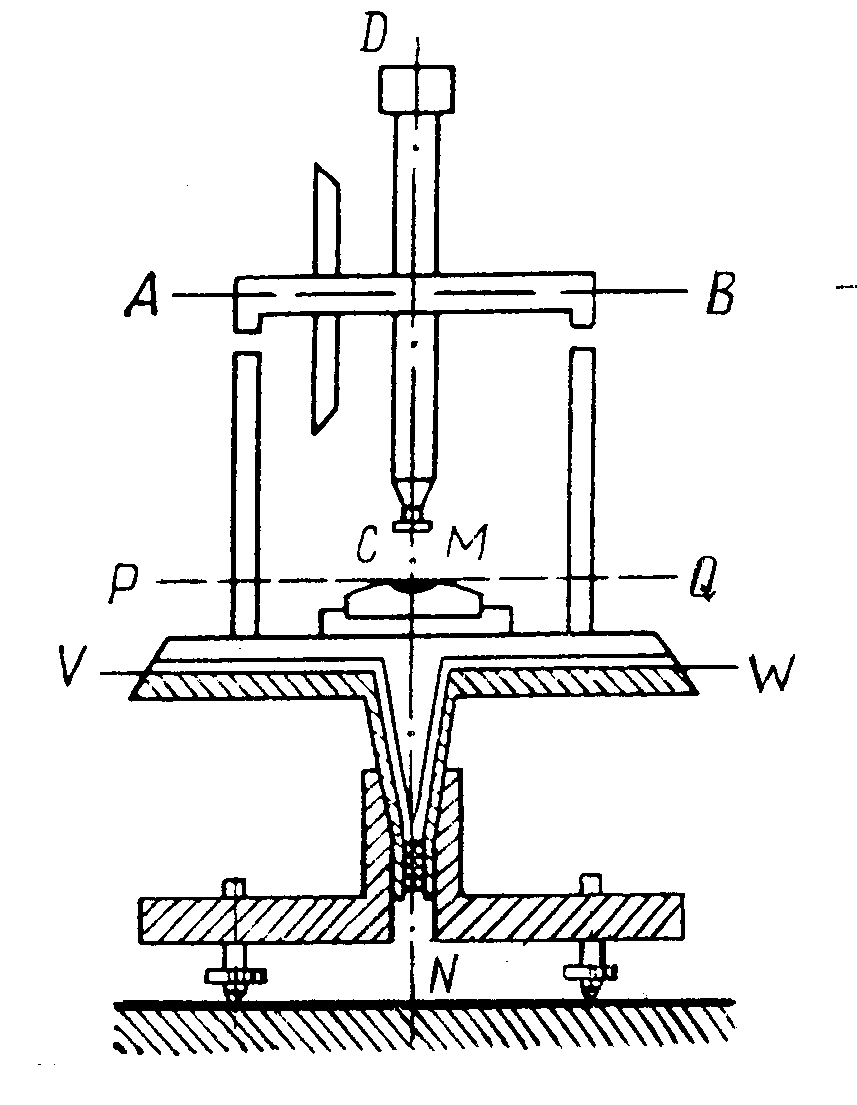
№5. Рассмотрите рисунок, ответьте на вопросы:
Обратите внимание! В восстановлении кислорода участвуют ионы Н + . Если концентрация Н + понижается (при повышении рН), восстановление О2 затрудняется. Замечено, что железо, находящееся в контакте с раствором, рН которого выше 9–10, не корродирует.
С усилением коррозии в присутствии солей часто сталкиваются автомобилисты в тех местностях, где в зимнее время для борьбы с гололедицей дороги обильно посыпают солью. Влияние солей объясняется тем, что образуемые ионы создают электролит, необходимый для возникновения замкнутой электрической цепи.

- Определить тип коррозии в каждом стакане.
- В каких стаканах железный гвоздь прокорродировал сильнее, в каких меньше, а в каких коррозии не подвергся? Почему?
- Объясните, что усиливает коррозию, а что ее замедляет?
№6. Рассмотрите процесс коррозии при соединении медной трубы с гальванизированной (оцинкованной) стальной трубой, если обе трубы находятся в земле.
№7. Почему цинк не используют при изготовлении консервных банок для покрытия им железа? Почему оцинкованное железо идёт на изготовления вёдер, баков?
№8. Как будет протекать процесс коррозии в том случае, если железную водосточную трубу прибить к дому алюминиевыми гвоздями?
№9. При изготовлении луженого железа (белой жести) — железо покрывают оловом, какое это покрытие — А) Анодное; Б) Катодное? Запишите электродные процессы
№10. Знаменитая Кутубская колонна в Индии близ Дели вот уже полторы тысячи лет стоит и не разрушается, несмотря на жаркий и влажный климат. Сделана она из железа, в котором почти нет примесей. Объясните, почему в данном случае статуя не подвергается коррозии
Защита металла от коррозии
Металлы используются человеком с доисторических времен, изделия из них широко распространены в нашей жизни. Самым распространенным металлом является железо и его сплавы. К сожалению, они подвержены коррозии, или ржавлению — разрушению в результате окисления. Своевременная защита от коррозии позволяет продлить срок службы металлических изделий и конструкций.

Виды коррозии
Ученые давно борются с коррозией и выделили несколько основных ее типов:
- Атмосферная. Происходит окисление вследствие контакта с кислородом воздуха и содержащимися в нем водяными парами. Присутствие в воздухе загрязнений в виде химически активных веществ ускоряет ржавление.
- Жидкостная. Проходит в водной среде, соли, содержащиеся в воде, особенно морской, многократно ускоряют окисление.
- Почвенная. Этому виду подвержены изделия и конструкции, находящиеся в грунте. Химический состав грунта, грунтовые воды и токи утечки создают особую среду для развития химических процессов.
Исходя из того, в какой среде будет эксплуатироваться изделие, подбираются подходящие методы защиты от коррозии.
Характерные типы поражения ржавчиной
Различают следующие характерные виды поражения коррозией:
- Поверхность покрыта сплошным ржавым слоем или отдельными кусками.
- На детали возникли небольшие участки ржавчины, проникающей в толщину детали.
- В виде глубоких трещин.
- В сплаве окисляется один из компонентов.
- Глубинное проникновение по всему объему.
- Комбинированные.

Виды коррозионных разрушений
По причине возникновения разделяют также:
- Химическую. Химические реакции с активными веществами.
- Электрохимическую. При контакте с электролитическими растворами возникает электрический ток, под действием которого замещаются электроны металлов, и происходит разрушение кристаллической структуры с образованием ржавчины.
Коррозия металла и способы защиты от нее
Ученые и инженеры разработали множество способов защиты металлических конструкций от коррозии.
Защита от коррозии индустриальных и строительных конструкций, различных видов транспорта осуществляется промышленными способами.
Зачастую они достаточно сложные и дорогостоящие. Для защиты металлических изделий в условиях домовладений применяют бытовые методы, более доступные по цене и не связанные со сложными технологиями.
Промышленные
Промышленные методы защиты металлических изделий подразделяются на ряд направлений:
- Пассивация. При выплавке стали в ее состав добавляют легирующие присадки, такие, как Cr, Mo, Nb, Ni. Они способствуют образованию на поверхности детали прочной и химически стойкой пленки окислов, препятствующей доступу агрессивных газов и жидкостей к железу.
- Защитное металлическое покрытие. На поверхность изделия наносят тонкий слой другого металлического элемента — Zn , Al, Co и др. Этот слой защищает железо о т ржавления.
- Электрозащита. Рядом с защищаемой деталью размещают пластины из другого металлического элемента или сплава, так называемые аноды. Токи в электролите текут через эти пластины, а не через деталь. Так защищают подводные детали морского транспорта и буровых платформ.
- Ингибиторы. Специальные вещества, замедляющие или вовсе останавливающие химические реакции.
- Защитное лакокрасочное покрытие.
- Термообработка.

Порошковая покраска для защиты от коррозии
Способы защиты от коррозии, используемые в индустрии, весьма разнообразны. Выбор конкретного метода борьбы с коррозией зависит от условий эксплуатации защищаемой конструкции.
Бытовые
Бытовые методы защиты металлов от коррозии сводятся, как правило, к нанесению защитных лакокрасочных покрытий. Состав их может быть самый разнообразный, включая:
- силиконовые смолы;
- полимерные материалы;
- ингибиторы;
- мелкие металлические опилки.
Отдельной группой стоят преобразователи ржавчины — составы, которые наносят на уже затронутые коррозией конструкции. Они восстанавливают железо из окислов и предотвращают повторную коррозию. Преобразователи делятся на следующие виды:
- Грунты. Наносятся на зачищенную поверхность, обладают высокой адгезией. Содержат в своем составе ингибирующие вещества, позволяют экономить финишную краску.
- Стабилизаторы. Преобразуют оксиды железа в другие вещества.
- Преобразователи оксидов железа в соли.
- Масла и смолы, обволакивающие частички ржавчины и нейтрализующие ее.

При выборе грунта и краски лучше брать их от одного производителя. Так вы избежите проблем совместимости лакокрасочных материалов.
Защитные краски по металлу
По температурному режиму эксплуатации краски делятся на две большие группы:
- обычные, используемые при температурах до 80 °С;
- термостойкие.
По типу связующей основы краски бывают:
- алкидные;
- акриловые;
- эпоксидные.
Лакокрасочные покрытия по металлу имеют следующие достоинства:
- качественная защита поверхности от коррозии;
- легкость нанесения;
- быстрота высыхания;
- много разных цветов;
- долгий срок службы.
Большой популярностью пользуются молотковые эмали, не только защищающие метал, но и создающие эстетичный внешний вид. Для обработки металла распространена также краска-серебрянка. В ее состав добавлена алюминиевая пудра. Защита металла происходит за счет образования тонкой пленки окиси алюминия.

Эпоксидные смеси из двух компонентов отличаются исключительной прочностью покрытия и применяются для узлов, подверженных высоким нагрузкам.
Защита металла в бытовых условиях
Чтобы надежно защитить металлические изделия от коррозии, следует выполнить следующую последовательность действий:
- очистить поверхность от ржавчины и старой краски с помощью проволочной щетки или абразивной бумаги;
- обезжирить поверхность;
- сразу же нанести слой грунта;
- после высыхания грунта нанести два слоя основной краски.
При работе следует использовать средства индивидуальной защиты:
- перчатки;
- респиратор;
- очки или прозрачный щиток.
Способы защиты металлов от коррозии постоянно совершенствуются учеными и инженерами.
Методы противостояния коррозионным процессам
Основные методы, применяемые для противодействия коррозии, приведены ниже:
- повышение способности материалов противостоять окислению за счет изменения его химического состава;
- изоляция защищаемой поверхности от контакта с активными средами;
- снижение активности окружающей изделие среды;
- электрохимические.
Первые две группы способов применяются во время изготовления конструкции, а вторые – во время эксплуатации.
Методы повышения сопротивляемости
В состав сплава добавляют элементы, повышающие его коррозионную устойчивость. Такие стали называют нержавеющими. Они не требуют дополнительных покрытий и отличаются эстетичным внешним видом. В качестве добавок применяют никель, хром, медь, марганец, кобальт в определенных пропорциях.

Нержавеющая сталь AISI 304
Стойкость материалов к ржавлению повышают также, удаляя их состава ускоряющие коррозию компоненты, как, например, кислород и серу — из стальных сплавов, а железо – из магниевых и алюминиевых.
Снижение агрессивности внешней среды и электрохимическая защита
С целью подавления процессов окисления во внешнюю среду добавляют особые составы — ингибиторы. Они замедляют химические реакции в десятки и сотни раз.
Электрохимические способы сводятся к изменению электрохимического потенциала материала путем пропускания электрического тока. В результате коррозионные процессы сильно замедляются или даже вовсе прекращаются.
Пленочная защита
Защитная пленка препятствует доступу молекул активных веществ к молекулам металла и таким образом предотвращают коррозионные явления.
Пленки образуются из лакокрасочных материалов, пластмассы и смолы. Лакокрасочные покрытия недороги и удобны в нанесении. Ими покрывают изделие в несколько слоев. Под краску наносят слой грунта, улучшающего сцепление с поверхностью и позволяющего экономить более дорогую краску. Служат такие покрытия от 5 до 10 лет. В качестве грунта иногда применяют смесь фосфатов марганца и железа.
Защитные покрытия создают также из тонких слоев других металлов: цинка, хрома, никеля. Их наносят гальваническим способом.
Покрытие металлом с более высоким электрохимическим потенциалом, чем у основного материала, называется анодным. Оно продолжает защищать основной материал, отвлекая активные окислители на себя, даже в случае частичного разрушения. Покрытия с более низким потенциалом называют катодными. В случае нарушения такого покрытия оно ускоряет коррозию за счет электрохимических процессов.
Металлическое покрытие также можно наносить также методом распыления в струе плазмы.
Применяется также и совместный прокат нагретых до температуры пластичности листов основного и защищающего металла. Под давлением происходит взаимная диффузия молекул элементов в кристаллические решетки друг друга и образование биметаллического материала. Этот метод называют плакированием.
Коррозия металла — причины возникновения и методы защиты
Словосочетания «коррозия металла» заключает в себе намного больше, чем название популярной рок-группы. Коррозия безвозвратно разрушает металл, превращая его в труху: из всего, произведенного в мире железа, 10% полностью разрушится в этот же год. Ситуация с российским металлом выглядит примерно так — весь металл, выплавленный за год в каждой шестой доменной печи нашей страны, становится ржавой трухой еще до конца года.
- Что такое коррозия металлов
- Химическая коррозия
- Электрохимическая коррозия
- Другие причины коррозии металла
- Меры защиты металлов от коррозии
- Антикоррозийная защита неметаллическими покрытиями
- Защита железа от коррозии покрытиями из других металлов
- Повышение коррозийной стойкости путем добавления в стальные сплавы легирующих добавок
- Меры противодействия электрохимической коррозии
- Защита от блуждающих токов

Выражение «обходится в копеечку» в отношении коррозии металла более чем верно — ежегодный ущерб, приносимый коррозией, составляет не менее 4% годового дохода любой развитой страны, а в России сумма ущерба исчисляется десятизначной цифрой. Так что же вызывает коррозийные процессы металлов и как с ними бороться?
Что такое коррозия металлов
Разрушение металлов в результате электрохимического (растворение во влагосодержащей воздушной или водной среде — электролите) или химического (образование соединений металлов с химическими агентами высокой агрессии) взаимодействия с внешней средой. Коррозийный процесс в металлах может развиться лишь в некоторых участках поверхности (местная коррозия), охватить всю поверхность (равномерная коррозия), или же разрушать металл по границам зерен (межкристаллитная коррозия).
Металл под воздействием кислорода и воды становится рыхлым светло-коричневым порошком, больше известным как ржавчина (Fе2O3·H2О).
Химическая коррозия
Этот процесс происходит в средах, не являющихся проводниками электрического тока (сухие газы, органические жидкости — нефтепродукты, спирты и др.), причем интенсивность коррозии возрастает с повышением температуры — в результате на поверхности металлов образуется оксидная пленка.
Химической коррозии подвержены абсолютно все металлы — и черные, и цветные. Активные цветные металлы (например — алюминий) под воздействием коррозии покрываются оксидной пленкой, препятствующей глубокому окислению и защищающей металл. А такой мало активный металл, как медь, под воздействием влаги воздуха приобретает зеленоватый налет — патину. Причем оксидная пленка защищает металл от коррозии не во всех случаях — только если кристаллохимическая структура образовавшейся пленки сообразна строению металла, в противном случае — пленка ничем не поможет.

Сплавы подвержены другому типу коррозии: некоторые элементы сплавов не окисляются, а восстанавливаются (например, в сочетании высокой температуры и давления в сталях происходит восстановление водородом карбидов), при этом сплавы полностью утрачивают необходимые характеристики.
Электрохимическая коррозия
Процесс электрохимической коррозии не нуждается в обязательном погружении металла в электролит — достаточно тонкой электролитической пленки на его поверхности (часто электролитические растворы пропитывают среду, окружающую металл (бетон, почву и т.д.)). Наиболее распространенной причиной электрохимической коррозии является повсеместное применение бытовой и технической солей (хлориды натрия и калия) для устранения льда и снега на дорогах в зимний период — особенно страдают автомашины и подземные коммуникации (по статистике, ежегодные потери в США от использования солей в зимний период составляют 2,5 млрд. долларов).
Происходит следующее: металлы (сплавы) утрачивают часть атомов (они переходят в электролитический раствор в виде ионов), электроны, замещающие утраченные атомы, заряжают металл отрицательным зарядом, в то время как электролит имеет положительный заряд. Образуется гальваническая пара: металл разрушается, постепенно все его частицы становятся частью раствора. Электрохимическую коррозию могут вызывать блуждающие токи, возникающие при утечке из электрической цепи части тока в водные растворы или в почву и оттуда — в конструкции из металла. В тех местах, где блуждающие токи выходят из металлоконструкций обратно в воду или в почву, происходит разрушение металлов. Особенно часто блуждающие токи возникают в местах движения наземного электротранспорта (например, трамваев и ж/д локомотивов на электрической тяге). Всего за год блуждающие токи силой в 1А способны растворить железа — 9,1 кг, цинка — 10,7 кг, свинца — 33,4 кг.
Другие причины коррозии металла
Развитию коррозийных процессов способствуют радиация, продукты жизнедеятельности микроорганизмов и бактерий. Коррозия, вызываемая морскими микроорганизмами, наносит ущерб днищам морских судов, а коррозийные процессы, вызванные бактериями, даже имеют собственное название — биокоррозия.

Совокупность воздействия механических напряжений и внешней среды многократно ускоряет коррозию металлов — снижается их термоустойчивость, повреждаются поверхностные оксидные пленки, а в тех местах, где появляются неоднородности и трещины, активируется электрохимическая коррозия.
Меры защиты металлов от коррозии
Неизбежными последствиями технического прогресса является загрязнение нашей среды обитания — процесс, ускоряющий коррозию металлов, поскольку внешняя окружающая среда проявляет к ним все большую агрессию. Каких-либо способов полностью исключить коррозийное разрушение металлов не существует, все, что можно сделать, это максимально замедлить этот процесс.
Для минимизации разрушения металлов можно сделать следующее: снизить агрессию среды, окружающей металлическое изделие; повысить устойчивость металла к коррозии; исключить взаимодействие между металлом и веществами из внешней среды, проявляющими агрессию.
Человечеством за тысячи лет испробованы многие способы защиты металлических изделий от химической коррозии, некоторые из них применяются по сей день: покрытие жиром или маслом, другими металлами, коррозирующими в меньшей степени (самый древний метод, которому уже более 2 тыс. лет — лужение (покрытие оловом)).
Антикоррозийная защита неметаллическими покрытиями
Неметаллические покрытия — краски (алкидные, масляные и эмали), лаки (синтетические, битумные и дегтевые) и полимеры образуют защитную пленку на поверхности металлов, исключающую (при своей целостности) контакт с внешней средой и влагой.
Применение красок и лаков выгодно тем, что наносить эти защитные покрытия можно непосредственно на монтажной и строительной площадке. Методы нанесения лакокрасочных материалов просты и поддаются механизации, восстановить поврежденные покрытия можно «на месте» — во время эксплуатации, эти материалы имеют сравнительно низкую стоимость и их расход на единицу площади невелик. Однако их эффективность зависит от соблюдения нескольких условий: соответствие климатическим условиям, в которых будет эксплуатироваться металлическая конструкция; необходимость применения исключительно качественных лакокрасочных материалов; неукоснительное следование технологии нанесения на металлические поверхности. Лакокрасочные материалы лучше всего наносить несколькими слоями — их количество обеспечит лучшую защиту от атмосферного воздействия на металлическую поверхность.

В роли защитных покрытий от коррозии могут выступать полимеры — эпоксидные смолы и полистирол, поливинилхлорид и полиэтилен. В строительных работах закладные детали из железобетона покрываются обмазками из смеси цемента и перхлорвинила, цемента и полистирола.
Защита железа от коррозии покрытиями из других металлов
Существует два типа металлических покрытий-ингибиторов — протекторные (покрытия цинком, алюминием и кадмием) и коррозионностойкие (покрытия серебром, медью, никелем, хромом и свинцом). Ингибиторы наносятся химическим способом: первая группа металлов имеет большую электроотрицательность по отношению к железу, вторая — большую электроположительность. Наибольшее распространение в нашем обиходе получили металлические покрытия железа оловом (белая жесть, из нее производят консервные банки) и цинком (оцинкованное железо — кровельное покрытие), получаемые путем протягивания листового железа через расплав одного из этих металлов.
Часто цинкованию подвергаются чугунная и стальная арматура, а также водопроводные трубы — эта операция существенно повышает их стойкость к коррозии, но только в холодной воде (при проводе горячей воды оцинкованные трубы изнашиваются быстрее неоцинкованных). Несмотря на эффективность цинкования, оно не дает идеальной защиты — цинковое покрытие часто содержит трещины, для устранения которых требуется предварительное никелерование металлических поверхностей (покрытие никелем). Цинковые покрытия не позволяют наносить на них лакокрасочные материалы — нет устойчивого покрытия.
Лучшее решение для антикоррозийной защиты — алюминиевое покрытие. Этот металл имеет меньший удельный вес, а значит — меньше расходуется, алюминированные поверхности можно окрашивать и слой лакокрасочного покрытия будет устойчив. Кроме того, алюминиевое покрытие по сравнению с оцинкованным покрытием обладает большей стойкостью в агрессивных средах. Алюминирование слабо распространено из-за сложности нанесения этого покрытия на металлический лист — алюминий в расплавленном состоянии проявляет высокую агрессию к другим металлам (по этой причине расплав алюминия нельзя содержать в стальной ванне). Возможно, эта проблема будет полностью решена в самое ближайшее время — оригинальный способ выполнения алюминирования найден российскими учеными. Суть разработки заключается в том, чтобы не погружать стальной лист в расплав алюминия, а поднять жидкий алюминий к стальному листу.
Повышение коррозийной стойкости путем добавления в стальные сплавы легирующих добавок
Введение в стальной сплав хрома, титана, марганца, никеля и меди позволяет получить легированную сталь с высокими антикоррозийными свойствами. Особенную стойкость стальному сплаву придает большая доля хрома, благодаря которому на поверхности конструкций образуется оксидная пленка большой плотности. Введение в состав низколегированных и углеродистых сталей меди (от 0,2% до 0,5%) позволяет повысить их коррозийную устойчивость в 1,5-2 раза. Легирующие добавки вводятся в состав стали с соблюдением правила Таммана: высокая коррозийная устойчивость достигается, когда на восемь атомов железа приходится один атом легирующего металла.
Меры противодействия электрохимической коррозии
Для ее снижения необходимо понизить коррозийную активность среды посредством введения неметаллических ингибиторов и уменьшить количество компонентов, способных начать электрохимическую реакцию. Таким способом будет понижение кислотности почв и водных растворов, контактирующих с металлами. Для снижения коррозии железа (его сплавов), а также латуни, меди, свинца и цинка из водных растворов необходимо удалить диоксид углерода и кислород. В электроэнергетической отрасли проводится удаление из воды хлоридов, способных повлиять на локальную коррозию. С помощью известкования почвы можно снизить ее кислотность.
Защита от блуждающих токов
Снизить электрокоррозию подземных коммуникаций и заглубленных металлоконструкций возможно при соблюдении нескольких правил:
- участок конструкции, служащий источником блуждающего тока, необходимо соединить металлическим проводником с рельсом трамвайной дороги;
- трассы теплосетей должны размещаться на максимальном удалении от рельсовых дорог, по которым передвигается электротранспорт, свести к минимуму число их пересечений;
- применение электроизоляционных трубных опор для повышения переходного сопротивления между грунтом и трубопроводами;
- на вводах к объектам (потенциальным источникам блуждающих токов) необходима установка изолирующих фланцев;
- на фланцевой арматуре и сальниковых компенсаторах устанавливать токопроводящие продольные перемычки — для наращивания продольной электропроводимости на защищаемом отрезке трубопроводов;
- чтобы выровнять потенциалы трубопроводов, расположенных параллельно, необходимо установить поперечные электроперемычки на смежных участках.
Защита металлических объектов, снабженных изоляцией, а также стальных конструкций небольшого размера выполняется с помощью протектора, выполняющего функцию анода. Материалом для протектора служит один из активных металлов (цинк, магний, алюминий и их сплавы) — он принимает на себя большую часть электрохимической коррозии, разрушаясь и сохраняя главную конструкцию. Один анод из магния, к примеру, обеспечивает защиту 8 км трубопровода.
Как предотвратить появление ржавчины на металле?
Автор: Анастасия Исакова · Опубликовано 15.09.2017 · Обновлено 15.09.2017
В каждом доме, среди домашней утвари, предметов интерьера имеются материалы, инструменты или детали, сделанные из металла. Они практичны, износостойки, но рано или поздно подвергаются коррозии. Как предотвратить этот процесс? Чем обработать металл, чтобы он не ржавел?
Методы борьбы со ржавчиной
Существует несколько методов, которые позволяют продлить срок эксплуатации железных деталей и предметов. Наиболее эффективный способ – это обработка химическими веществами. К ним относятся ингибиторные составы, которые покрывают металлические предметы тонкой пленкой. Именно она позволяет предохранить от разрушения изделия. Такие препараты часто используют и в профилактических целях.
Рассмотрим основные методы, позволяющие предотвратить коррозию:
- механическое удаление ржавчины;
- обработка химическими веществами;
- антикоррозийные вещества;
- народные средства от ржавчины.

Механическая очистка
Чтобы выполнить механическую обработку от коррозии вручную, необходимо приобрести щетку по металлу или крупнозернистую абразивную шкурку. Предметы можно обрабатывать сухим или мокрым способом. В первом варианте происходит обычное соскабливание ржавчины, а во втором – шкурка смачивается в растворе Уайт-спирита или в керосине.
Также провести механическую очистку ржавеющих материалов можно с помощью аппаратных средств, таких как:

- Шлифовальная машинка.

- Электродрель с насадкой-металлической щеткой.

- Пескоструйный аппарат.

Безусловно, ручным способом можно более тщательно очистить поверхность. Но применяется он на небольших площадях. Аппаратные материалы ускорят рабочий процесс, но при этом они могут нанести вред деталям. Во время обработки снимется большой слой металла. Наиболее оптимальный вариант, который бережно удалит коррозию – пескоструйный аппарат. У такого оборудования есть свой небольшой недостаток – высокая стоимость.
При обработке предметов пескоструйным оборудованием металлическая поверхность не стачивается, а сохраняет свою структуру. Мощная струя песка бережно удаляет ржавчину.

Обработка химическими веществами
Химические препараты делятся на две группы:
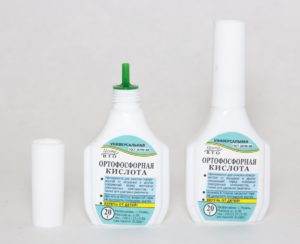
- Кислоты (наиболее популярная ортофосфорная);
- Преобразователи ржавчины.
Под кислотами, зачастую, подразумеваются обычные растворители. Одни из них имеют ортофосфорный состав, который позволяет восстановить ржавеющий материал. Способ применения кислоты довольно простой: протрите железо или металл от пыли влажной тряпкой, затем уберите остатки влаги, тонким слоем нанесите кислоту силиконовой кистью на предмет.
Вещество вступит в реакцию с поврежденной поверхностью, оставьте его на 30 минут. Когда деталь будет очищена, протрите обработанное место сухой тряпкой. Перед использованием химических средств от ржавчины наденьте спецодежду. В ходе работы позаботьтесь, чтобы состав не попал вам на открытые участки кожи.
Ортофосфорная кислота имеет ряд преимуществ в сравнении с другими составами. Она бережно воздействует на металлические предметы, удаляет ржавчину и препятствует появлению новых участков заражения.
Преобразователи ржавчины наносятся на всю металлическую поверхность, при этом образуют защитный слой, который в дальнейшем предотвратит коррозию всего предмета. После того как состав высохнет, можно вскрыть его краской или лаком. На сегодняшний день в строительной индустрии производится большое количество преобразователей, наиболее популярными из них являются:
- Модификатор ржавчины Berner. Предназначен для обработки болтов и гаек, которые не поддаются демонтажу.

- Нейтрализатор ржавчины ВСН -1. Используется на небольших участках. Нейтрализует поржавевшие места, образуя серую пленку, которая легко вытирается сухой тряпкой.

- Аэрозоль «Цинкор». Обезжиривающий состав позволяет восстановить предметы, которые находятся в ржавлении, образует защитную пленку на поверхности.

- Уничтожитель ржавчины В-52 . Это гель быстрого действия, не растекается, он удаляет любые виды коррозии.

- Преобразователь СФ-1. Используется для чугунных, оцинкованных, алюминиевых поверхностей. Удаляет ржавчину, после обработки защищает материал, продлевает его срок эксплуатации до 10 лет.
Большая часть антикоррозийных веществ состоит из токсичных химических соединений. Позаботьтесь, чтобы у вас обязательно был респиратор. Так вы обезопасите слизистую дыхательных путей от раздражения.

Применение антикоррозийных составов
Одна из ведущих химических компаний «Rocket Chemical» предлагает широкий ассортимент антикоррозийной продукции. Но наиболее эффективной считается линейка из пяти веществ:
- Ингибитор продолжительного действия. Обработанные веществом металлические изделия могут находиться круглый год на улице. При этом они защищены от любых погодных воздействий, которые провоцируют коррозийный процесс.

- Защитная литиевая смазка. Материал наносится на поверхность для защиты и профилактики ржавления. Он рекомендуется для нанесения на дверные петли, цепи, тросы, реечные механизмы. Образует защитную пленку, которая не смывается атмосферными осадками.

- Водостойкая силиконовая смазка. Благодаря своему силиконовому составу смазка наносится на металлические поверхности с элементами пластика, винила и резины. Быстро высыхает, образует тонкое, прозрачное, не липкое покрытие.

- Спрей от ржавчины. Препарат применяется для обработки труднодоступных мест, предназначен для глубокого проникновения, защищает изделия от повторного появления ржавчины. Широко используется для обработки резьбовых соединений и болтов от коррозии.

- Раствор, удаляющий коррозийные пятна. В состав раствора входят нетоксичные вещества. Он может применяться как для обработки строительных материалов, так и различных кухонных принадлежностей. Как сделать, чтобы нож не ржавел? Смело обрабатываем его раствором, оставляем на 5 часов, после хорошо вымываем с помощью моющего средства. И нож снова готов к эксплуатации.

На видео: разрушитель ржавчины WD-40.
Народные средства
Что делать если на химические препараты аллергия, а ржавчину с металлических предметов очистить надо? Не отчаивайтесь, существует множество народных средств, которые ничуть не уступают заводским препаратам:
- Cilit — средство для чистки налета и ржавчины в ванной комнате и кухни. Этот гель часто применяется для кранов, смесителей, если нож ржавеет или другие металлические приборы. Также используется для удаления коррозии с любых железных и металлических изделий. Но следует помнить, что его химический состав может разъесть краску.
- Раствор из керосина и парафина. Его нужно приготовить в соотношении 10:1. Оставить настояться на сутки. После обрабатываем поврежденные ржавчиной предметы, оставляем на 12 часов. В завершение нужно очистить обработанное место сухой тряпкой. Такой метод подойдет для строительных материалов и инструментов.
- Coca Cola против ржавчины. Ее щелочной состав разъедает коррозийные пятна. Для этого погрузите предмет в емкость с напитком или смочите тряпку. Оставьте на сутки, после промойте предмет под проточной водой.

Как видите, нет ничего невозможного. Следовательно, выберите для себя более приемлемый вариант, чтобы вернуть металлическим изделиям первозданный вид.
Топ 5 способов удаления ржавчины (1 видео)
Защита от ржавчины на металле в домашних условиях
Содержание
Металлические изделия окружают нас в повседневной жизни. Однако металл активно взаимодействует с окружающей средой и со временем покрывается слоем ржавчины. Этот процесс называется коррозия.
Ученые считают, что от коррозии ежегодно приходит в полную негодность около 10% от общего количества производимого металла, что в цифрах равняется годовому объему продукции крупного металлургического комбината.
Как и почему возникает ржавчина?
Для незащищенного металла практически все среды, в которых он находится, являются агрессивными. Поэтому его поверхность подвергается химическим реакциям. В результате этих реакций появляется ржавчина, и металл теряет как внешний вид, так и прочностные характеристики.
[ro-youtube-content count=”1″ no-desc=”0″]Защита от ржавчины на металле в домашних условиях[/ro-youtube-content]

Типичный пример ржавления металла мы видим в повседневной жизни. Ржавчиной покрываются металлические лестницы, перила балконных и мостовых ограждений, металлические заборы. Также, коррозии подвергаются и металлы, которые работают в условиях высоких температур – арматура плавильных печей, детали двигателей, лопасти турбин.
Не менее подвержены коррозии металлы, соприкасающиеся с жидкостями – спиртом, водой, нефтью, мазутом.
Электрохимическая коррозия металла в воде наступает вследствие реакции с растворенным в ней кислородом.
Из всего вышесказанного возникает вопрос, а чем покрыть металл от коррозии и тем самым продлить срок его эксплуатации?
Защита от ржавчины.
Защитить металл от коррозии можно. Для этого любое металлическое изделие следует покрыть защитной пленкой, которая будет различаться от структуры и химического состава металла. Существует много способов защиты металла от коррозии.

В быту есть понятие “изделие из нержавейки”. Это значит, что используется легированная сталь. Как покрасить лакированную мебель в белый цвет в домашних условиях?
Долгое время нечувствительными к атмосферной коррозии могут оставаться легированные стали с добавлением хрома, меди, которые используют в строительстве. Чем меньше содержание примесей в стали и выше ее однородность, тем менее она подвержена коррозии.
Защитные покрытия, наносимые промышленным способом.
Защитное покрытие выполняется чаще всего в виде пленки (металлической, оксидной, лакокрасочной).
Для создания металлической защитной пленки используют метод гальванизации, нанесения металлов горячим способом или металлизации. Для этого металлическое изделие погружается в емкость с расплавленным защитным материалом (олово, свинец, цинк) с такой температурой, при которой защищаемый металл не плавится. Преимуществом метода металлизации является возможность покрыть защитным слоем уже готовые собранные изделия.
Защитное покрытие также наносят методом диффузии в основной металл другого — алюминия (алитирование или алюминирование), кремния (силицирование), хрома (хромирование), а также создания биметалла способом плакирования.
Еще один способ защиты от коррозии – оксидирование. Поскольку на металле присутствует естественная оксидная пленка, ее делают более прочной, обрабатывая окислителем (растворами кислот или их солей). Одним из видов нанесения такой пленки горячим способом является “воронение” стали.
Также горячим способом выполняется фосфатирование металла (погружение в горячий раствор кислых фосфатов железа или марганца).
Сантехнические изделия (ванны, раковины) покрываются защитным лакокрасочным слоем (эмалируются) в промышленных условиях при очень высоких температурах (до 800°С).
Для защиты металлов во время транспортировки или для хранения металлических конструкций на складах используют жидкие масла или ингибиторы.
Защитные покрытия, применяемые в быту.
Как уже упоминалось ранее, антикоррозионной защиты требуют и обычные металлические изделия, окружающие нас в повседневном быту. В каждой квартире, а тем более в частном доме, имеется большое количество металлических деталей – балконные ограждения, заборы, решетки, гаражи, садовая техника, радиаторы, трубы холодной и горячей воды, садовые скамейки, которые покрываются со временем ржавчиной.
Доступным способом их защиты является нанесение вручную антикоррозионного покрытия в виде грунтовки или краски по ржавчине. Эти покрытия имеют специальный состав, содержащий ингибиторы и различные добавки, что позволяет наносить их непосредственно на слой ржавчины, предварительно не зачищая металл.
В состав грунтовки, например, входит преобразователь ржавчины и антикоррозионный грунт. Это очень эффективное средство, которое часто используют как самостоятельное покрытие. Такой грунт надежно будет защищать покрытую поверхность от различных атмосферных проявлений (град, снег, дождь, солнце).
Антикоррозионная краска отличается от грунта тем, что в ее состав дополнительно включен такой компонент как износостойкая эмаль, что обеспечивает очень быстрое высыхание краски на воздухе. Ее достоинство в том, что она наносится на любую поверхность (с остатками предыдущей краски, покрытую ржавчиной) из стали, чугуна, железа или железобетона. Нанесение слоя такой краски продлевает, как минимум вдвое, срок службы металлических изделий.
Из всего вышесказанного видно, что существует много различных способов, чем покрыть металл от коррозии. И в зависимости от вида покрываемого металла не составит труда выбрать нужный и эффективный, который защитит металл от ржавчины.
Дополнительная информация:
[ro-youtube-related]Защита от ржавчины на металле в домашних условиях[/ro-youtube-related]
Антикоррозийная защита материала в домашних условиях подразумевает применение ЛКМ-покрытий и химических средств. Свойства защитного плана обеспечивают сочетанием разных элементов: смол на основе силикона, ингибиторов, полимеров, металлической стружки и пудры.
Коррозия представляет собой процесс, сопровождающийся разрушением поверхностных слоев конструкций из стали и чугуна, возникающий в результате электрохимического и химического воздействия. Негативным следствием этого становится серьезная порча металла, его разъедание, что не позволяет использовать его по назначению.
В каждом доме, среди домашней утвари, предметов интерьера имеются материалы, инструменты или детали, сделанные из металла. Они практичны, износостойки, но рано или поздно подвергаются коррозии. Как предотвратить этот процесс?
Чем обработать металл, чтобы он не ржавел?
Пленки образуются из лакокрасочных материалов, пластмассы и смолы. Лакокрасочные покрытия недороги и удобны в нанесении. Ими покрывают изделие в несколько слоев.
Термическое воронение стали в домашних условиях? Под краску наносят слой грунта, улучшающего сцепление с поверхностью и позволяющего экономить более дорогую краску. Служат такие покрытия от 5 до 10 лет.
В качестве грунта иногда применяют смесь фосфатов марганца и железа.
Для эффективной защиты от коррозии, необходимо обеспечить взаимодействие двух металлов: железа и цинка. Лишь в этом случае (да и то с ограничениями) возникает электрохимический контакт пары металлов, в котором в первую очередь разрушению (коррозии) подвергается цинк, тем самым предохраняя железо (протекторное действие). Так называемые цинкнаполненные краски представляют собой лишь обычную краску, в которую добавлена цинковая пудра.
Такое покрытие не обеспечит электрохимического взаимодействия железа и цинка, потому как сама краска является диэлектриком.
Следы легкого окисления, неглубокий налет коррозии, воронение и пр. следы химического окрашивания металла (намеренноно и непреднамеренного) легко и бысто удаляет автополироль. Берите наименее абразивную и не жадничайте – импортную (США, германия и пр.) Небольшой баночки (например, на основе масла Карнаубы) хватит на очень продолжительное время, а если есть машина то остатки тем более не пропадут. (Александр Марьянко)
Коррозионное разрушение – это явление, которое видел каждый. Чем быстро снять краску с дерева в домашних условиях? Образование ржавчины на металлической поверхности лишь один из признаков.
Коррозионный процесс вызывает разъедание материала под воздействием факторов окружающей среды. Как правило, речь идет о влаге. Вода окисляет металл, провоцируя его последующее разрушение.
Не, просто воронение слабо защищает от ржавчины. Консервационная смазка, оружейная – это да.
Из практического опыта – у меня воздушка (несмазанная, ну так получилось, вовремя не законсервировал) провалялась в гараже месяца 2 без дела, и за это время вороненый ствол успел покрыться мелкими “цяточками” ржавчины. Так что смазка – обязательно!
Процесс коррозии имеет четыре главных элемента: это катод (электрод с катодной реакцией), атод (электрод с анодной реакцией), металл (проводник электронов) и проводник ионов (жидкость, проводящая электрический ток). Катод и анод соприкасаются с проводниками ионов, в которых далее возникает электродное напряжение. При соприкосновении электродов (катод и анод) возникает коррозийная реакция из-за разности электродных потенциалов. В результате образуется коррозийная пара, в которой анод начинает разъедать металл.
Таким образом, все меры по защите металла направлены на то, чтобы исключить образование коррозийных пар или же замедлить их развитие.


 Пассивация. В процессе производства в сталь добавляются другие металлические сплавы (молибден, никель, ниобий). Эти материалы характеризуются отличными эксплуатационными свойствами и высокой стойкостью к агрессивным воздействиям. Эти разновидности стали принято называть легированными.
Пассивация. В процессе производства в сталь добавляются другие металлические сплавы (молибден, никель, ниобий). Эти материалы характеризуются отличными эксплуатационными свойствами и высокой стойкостью к агрессивным воздействиям. Эти разновидности стали принято называть легированными. Перед тем как наносить преобразователь или грунтовую смесь, поверхность необходимо полностью очистить от маслянистых пятен, следов коррозии и различного рода загрязнений. Для этих мер можно воспользоваться болгаркой или щетками с металлическим ворсом.
Перед тем как наносить преобразователь или грунтовую смесь, поверхность необходимо полностью очистить от маслянистых пятен, следов коррозии и различного рода загрязнений. Для этих мер можно воспользоваться болгаркой или щетками с металлическим ворсом.