Относительная молярная и молекулярная массы вещества. Молярный объем вещества
Задачи по химии
Химия 8 класс. Раздел: «Первоначальные химические представления». Тема урока: «Относительная молярная и молекулярная массы вещества. Молярный объем вещества».
- На уроке рассмотрены следующие вопросы:
Урок 9. Молярная масса и молярный объем
В уроке 9 «Молярная масса и молярный объем» из курса «Химия для чайников» выясним, что подразумевается под молярной массой и молярным объемом; приведем формулы для их вычисления. Напоминаю, что в прошлом уроке «Химическое количество вещества и моль» мы выяснили, что такое химическое количество вещества; рассмотрели моль в качестве единицы количества вещества, а также познакомились с постоянной Авогадро.

Молярная масса
Вы знаете, что одинаковое химическое количество любых веществ содержит одно и то же число структурных единиц. Но у каждого вещества его структурная единица имеет собственную массу. Поэтому и массы одинаковых химических количеств различных веществ тоже будут различны.
Молярная масса — это масса порции вещества химическим количеством 1 моль.
Молярная масса вещества Х обозначается символом M(Х) . Она равна отношению массы данной порции вещества m(Х) (в г или кг) к его химическому количеству n(Х) (в моль):
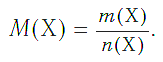
В Международной системе единиц молярная масса выражается в кг/моль. В химии чаще используется дольная единица — г/моль.
Определим молярную массу углерода. Масса углерода химическим количеством 1 моль равна 0,012 кг, или 12 г. Отсюда:
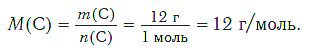
Молярная масса любого вещества, если она выражена в г/моль, численно равна его относительной молекулярной (формульной) массе.
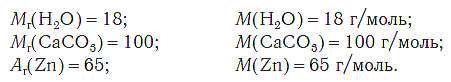
На рисунке 47 показаны образцы веществ (H2O, CaCO3, Zn), химическое количество которых одно и то же — 1 моль. Как видите, массы разных веществ химическим количеством 1 моль различны.

Молярная масса является важной характеристикой каждого отдельного вещества. Она отражает зависимость между массой и химическим количеством вещества. Зная одну из этих величин, можно определить вторую — массу по химическому количеству:
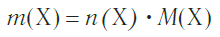
и, наоборот, химическое количество по массе:
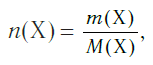
а также число структурных единиц:
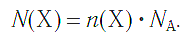
Взаимосвязь между этими тремя характеристиками вещества в любом его агрегатном состоянии можно выразить простой схемой:
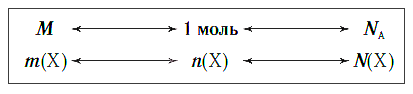
Молярный объем
В отличие от твердых и жидких веществ все газообразные вещества химическим количеством 1 моль занимают одинаковый объем (при одинаковых условиях). Эта величина называется молярным объемом и обозначается Vm .
Подобно молярной массе, молярный объем газа равен отношению объема данного газообразного вещества V(Х) к его химическому количеству n(Х) :
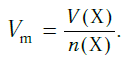
Так как объем газа зависит от температуры и давления, то при проведении различных расчетов берутся обычно объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимаются температура 0 °С и давление 101,325 кПа.
Установлено, что при нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная 22,4 дм 3 /моль. Другими словами, молярный объем любого газа при нормальных условиях:
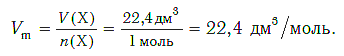
Молярный объем — это объем, равный 22,4 дм 3 , который занимает 1 моль любого газа при нормальных условиях.
Пример 1. Вычислите химическое количество SiO2, масса которого равна 240 г.

Пример 2. Определите массу серной кислоты H2SO4, химическое количество которой 2,5 моль.

Пример 3. Сколько молекул CO2 и сколько атомов кислорода содержится в углекислом газе массой 110 г?

Пример 4. Какой объем занимает кислород химическим количеством 5 моль при нормальных условиях?

Краткие выводы урока:
- Масса вещества химическим количеством 1 моль называется его молярной массой. Она равна отношению массы данной порции вещества к его химическому количеству.
- Объем газообразных веществ химическим количеством 1 моль при нормальных условиях одинаков и равен 22,4 дм 3 .
- Величина, равная 22,4 дм 3 /моль, называется молярным объемом газов.
Надеюсь урок 9 «Молярная масса и молярный объем» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «Основные химические понятия».
Решение задач по химии
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров по данной теме.

Относительная атомная масса — Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса — Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества. В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Моль и число Авогадро
Моль — единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12 C, т.е. 6 × 10 23 .
Число Авогадро (постоянная Авогадро, NA) — число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль — международная единица количества вещества, которая показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества содержит 6.02 × 10 23 атомов/молекул/ионов — вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии обозначается N, ν (по греч. читается «ню»).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 10 23 молекул воды и 12.04 × 10 23 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса — M
Молярная масса — масса одного моля вещества, выражается в «г/моль» (грамм/моль). Численно совпадает с изученной нами ранее относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали молярные массы — массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 10 23 молекул), молекулярные массы отличаются. Так, 6.02 × 10 23 молекул N2 весят 28 грамм, а такое же количество молекул HCl — 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково — 6.02 × 10 23 , в их состав входят разные атомы, поэтому и массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции. Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 10 23 молекул азота, 3.01 × 10 23 молекул CaCO3 и 18.06 × 10 23 молекул HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества. Практика — лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем — объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре и давлении составляет 22.4 л/моль. Он обозначается как — VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом 33.6 литра. Поскольку показательно молярного объема при н.у. — константа (22.4 л/моль), то совершенно неважно, какой газ мы возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ все же надо выбрать, выберем хлор — Cl2.


Моль (количество вещества) — самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи — выполнена 🙂

Относительная плотность и газы — D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере. Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): «Плотность неизвестного вещества по кислороду 3.5, найдите молярную массу неизвестного вещества»

Относительная плотность и водный раствор — ρ
Пишу об этом из-за исключительной важности в решении сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы измерения плотности: г/мл, г/см 3 , кг/м 3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении — так вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки, если вы будете следовать моему правилу и относится к обозначенным условным единицам «как к числам», то не запутаетесь.
В ходе ваших действий «грамм» и «грамм» должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае вы бы получили граммы в квадрате 🙂
К примеру, даны масса раствора HCl — 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля — ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю в долях от единицы, если хотите получить в процентах — его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Количество вещества, моль, молярная масса и молярный объем
Разделы: Химия
Урок 1.
Тема: Количество вещества. Моль
Химия – это наука о веществах. А как измерять вещества? В каких единицах? В молекулах, из которых состоят вещества, но сделать это очень сложно. В граммах, килограммах или миллиграммах, но так измеряют массу. А что если объединить массу, которую измеряют на весах и число молекул вещества, возможно ли это?
а) H-водород
1а.е.м = 1,66*10 -24 г
Возьмем 1г водорода и подсчитаем количество атомов водорода в этой массе (предложите это сделать ученикам с помощью калькулятора).
Nн= 1г / (1,66*10 -24 ) г = 6,02*10 23
б) O-кислород
Ао= 16а.е.м = 16*1.67* 10 -24 г
No= 16г / (16 *1.66 * 10 -24 ) г =6,02 * 10 23
в) C-углерод
Ас= 12а.е.м = 12*1.67*10 -24 г
Nc= 12г / (12* 1.66*10 -24 ) г = 6,02*10 23
Сделаем вывод: если мы возьмем такую массу вещества, которая равна атомной массе по величине, но взята в граммах, то там будет всегда (для любого вещества) 6.02 *10 23 атомов этого вещества.
 = 18 а.е.м.
= 18 а.е.м.
 = 18г / (18* 1.66*10 -24 ) г =6,02*10 23 молекул воды и т.д.
= 18г / (18* 1.66*10 -24 ) г =6,02*10 23 молекул воды и т.д.
Nа = 6,02*10 23 — число или постоянная Авогадро.
Моль — количество вещества, в котором содержится 6,02 *10 23 молекул, атомов или ионов, т.е. структурных единиц.
Бывает моль молекул, моль атомов, моль ионов.
 , где
, где
n – число молей,(число молей часто обозначают  — ню),
— ню),
N — число атомов или молекул,
Nа = постоянная Авогадро.
Кмоль = 10 3 моль, ммоль = 10 -3 моль.
Показать портрет Амедео Авогадро на мультимедийной установке и кратко рассказать о нем, или поручить ученику подготовить небольшой доклад о жизни учёного.
Урок 2.
Тема « Молярная масса вещества»
Чему же равна масса 1 моля вещества? ( Вывод учащиеся часто могут сделать сами.)
Масса одного моля вещества равна его молекулярной массе, но выражена в граммах. Масса одного моля вещества называется молярной массой и обозначается – M.

Формулы:
 , где
, где
М — молярная масса,
n — число молей,
m — масса вещества.
Масса моля измеряется в г/моль, масса кмоля измеряется в кг/кмоль, масса ммоля измеряется в мг/моль.
Заполнить таблицу (таблицы раздаются).
Вещество
Число молекул
N=Nan
Молярная масса
M= 
(рассчитывается по ПСХЭ)
Число молей
n ( )=
)= 
Масса вещества
m = M n
5моль
980г
12,04*10 26
Урок 3.
Тема: Молярный объем газов
Решим задачу. Определите объем воды, масса которой при нормальных условиях 180 г.
Дано:
 (H2O) = 1 г/мл
(H2O) = 1 г/мл
V(H2O) =?
Т.е. объем жидких и твердых тел считаем через плотность.
Но, при расчёте объёма газов не обязательно знать плотность. Почему?
Итальянский ученый Авогадро определил, что в равных объемах различных газов при одинаковых условиях (давлении, температуре) содержится одинаковое число молекул — это утверждение называется законом Авогадро.
Т.е. если при равных условиях V(H2) =V(O2) , то n(H2) =n(O2), и наоборот если при равных условиях n(H2) =n(O2) то и объемы этих газов будут одинаковы. А моль вещества всегда содержит одно и тоже число молекул 6,02 *10 23 .
Делаем вывод – при одинаковых условиях моли газов должны занимать один и тот же объем.
При нормальных условиях (t=0, P=101,3 кПа. или 760 мм рт. ст.) моли любых газов занимают одинаковый объем. Этот объем называется молярным.
Vm=22,4 л/моль
1кмоль занимает объём -22,4 м 3 /кмоль, 1ммоль занимает объем -22,4 мл/ммоль.
Пример 1. (Решается на доске):
Пример 2. (Можно предложить решить ученикам):
Предложить учащимся заполнить таблицу.
Вещество
Число молекул
N = n Na
Масса вещества
m = M n
Число молей
n = 
Молярная масса
M= 
(можно определить по ПСХЭ)
Объем
V=Vm n
Относительная молярная и молекулярная массы вещества. Молярный объем вещества
Моль, молярная масса
В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль .
Моль — это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное постоянной Авогадро
Постоянная Авогадро NA определяется как число атомов, содержащееся в 12 г изотопа 12 С:
Таким образом, 1 моль любого вещества содержит 6,02 • 10 23 частиц этого вещества.
1 моль кислорода содержит 6,02 • 10 23 молекул O2 .
1 моль серной кислоты содержит 6,02 • 10 23 молекул H 2 SO 4 .
1 моль железа содержит 6,02 • 10 23 атомов Fe.
1 моль серы содержит 6,02 • 10 23 атомов S.
2 моль серы содержит 12,04 • 10 23 атомов S.
0,5 моль серы содержит 3,01 • 10 23 атомов S.
Исходя из этого, любое количество вещества можно выразить определенным числом молей ν (ню). Например, в образце вещества содержится 12,04 • 10 23 молекул. Следовательно, количество вещества в этом образце составляет:


где N – число частиц данного вещества;
N а – число частиц, которое содержит 1 моль вещества (постоянная Авогадро).
Молярная масса вещества (M) – масса, которую имеет 1 моль данного вещества.
Эта величина, равная отношению массы m вещества к количеству вещества ν, имеет размерность кг/моль или г/моль. Молярная масса, выраженная в г/моль, численно равна относительной относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar).
Например, молярная масса метана CH4 определяется следующим образом:
M(CH4)=16 г/моль, т.е. 16 г CH4 содержат 6,02 • 10 23 молекул.
Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) ν, по формуле:

Соответственно, зная массу и молярную массу вещества, можно рассчитать число его молей:

или найти массу вещества по числу молей и молярной массе:
Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т.е. зависит от Mr и Ar. Поэтому разные вещества при одинаковом количестве молей имеют различные массы m.

Пример
Вычислить массы метана CH4 и этана С2H6, взятых в количестве ν = 2 моль каждого.
Решение
Молярная масса метана M(CH4) равна 16 г/моль;
молярная масса этана M(С2Н6) = 2 • 12+6=30 г/моль.
Отсюда:
m(CH4) = 2 моль • 16 г/моль = 32 г;
m(С2Н6) = 2 моль • 30 г/моль = 60 г.
Таким образом, моль – это порция вещества, содержащая одно и то же число частиц, но имеющая разную массу для разных веществ, т.к. частицы вещества (атомы и молекулы) не одинаковы по массе.

Вычисление ν используется практически в каждой расчетной задаче.
Образцы решения задач
Задача №1. Вычислите массу (г) железа, взятого количеством вещества
Дано: ν ( Fe )=0,5 моль
M ( Fe ) = Ar ( Fe ) = 56 г/моль (Из периодической системы)
m ( Fe ) = 56 г/моль · 0,5 моль = 28 г
Ответ: m ( Fe ) =28 г
Задача №2. Вычислите массу (г) 12,04 · 10 23 молекул оксида кальция Ca О?
Дано: N ( CaO )= 12,04 * 10 23 молекул
m = M · ν , ν= N / Na ,
следовательно, формула для расчёта
M(CaO) = Ar(Ca) + Ar(O) = 40 + 16 = 56 г / моль
m = 56 г/моль · (12,04 * 10 23 /6.02 · 10 23 1/моль) = 112 г
Интерактивны тесты
Задания для закрепления
Задача 1. Вычислите массу воды (г), взятой количеством вещества 5 моль?
Задача 2. Вычислите массу 24,08 *10 23 молекул серной кислоты H2SO4?
Задача 3. Определите число атомов в 56 г железа Fe ?
Относительная молярная и молекулярная массы вещества. Молярный объем вещества
Письмо с инструкцией по восстановлению пароля
будет отправлено на вашу почту
- Главная
- 8-Класс
- Химия
- Видеоурок «Количество вещества. Моль. Молярная масса»
- § 1 Количество вещества
- § 2 Моль
- § 3 Молярная масса
В химической практике, имея дело с веществами, а не с отдельными атомами или молекулами, химики редко используют массы, измеряемые в атомных единицах. Масса порции реагирующих веществ или продуктов реакции чаще измеряется в граммах или в более крупных единицах.
Чтобы перейти от молекул к порциям веществ, воспользуемся единицей измерения, которая называется моль.
Химик и физик из Франции Жозеф Луи Гей-Люссак в 1808 году изучал интересную химическую реакцию, в которой в результате взаимодействия двух газов – хлороводорода и аммиака – получалось кристаллическое вещество – хлорид аммония.

Оказалось, что для реакции требуются одинаковые объемы хлороводорода и аммиака. Если одного из этих газов вначале будет больше, то по окончании реакции этот избыток оставался неиспользованным.

Гей-Люссак привел свои наблюдения в статье, но никаких выводов из них не сделал. Важные заключения через три года привел итальянский химик Амедео Авогадро. В 1811 году, в результате экспериментов и расчетов, Авогадро пришел к мысли, что равные объемы газов, находящихся при одинаковых условиях, содержат одно и то же число молекул.
Гипотеза Авогадро долго считалась спорной, поскольку не подтверждалась расчетами, основанными на ошибочном мнении о немолекулярном строении простых газообразных веществ. Однако в 1865 году австрийский физик и химик Иоганн Лошмидт предпринял попытку рассчитать число молекул газа в заданном объеме.
Когда гипотеза Авогадро была признана, ученые получили возможность правильно определять состав молекул химических соединений, рассчитывать атомные и молекулярные массы. Эти знания позволяли легко рассчитывать массовые соотношения веществ в химических реакциях. Пользоваться этими соотношения очень удобно: измеряя массу веществ в граммах, ученые как бы оперировали молекулами.
Количество вещества, численно равное относительной молекулярной массе, но выраженное в граммах, назвали грамм-молекулой или молем.

Слово «моль» придумал в начале XX века немецкий физико-химик, лауреат Нобелевской премии Вильгельм Оствальд. Слово происходит от слова «молекула».
Моль – это количество вещества, содержащее столько структурных единиц (атомов, молекул), сколько содержится атомов в 0,012 кг углерода.
Согласно Международной системе единиц СИ моль является единицей измерения особой физической величины – количества вещества. Под количеством вещества (обозначается греческой буквой ν) понимают число структурных единиц этого вещества (атомов, молекул и др.).

Самое важное заключается в том, что 1 моль любого вещества содержит одно и то же число молекул. Это число называется постоянной или числом Авогадро. Она обозначается символом NA. Постоянная Авогадро рассчитана давно и представляет собой очень большое число.
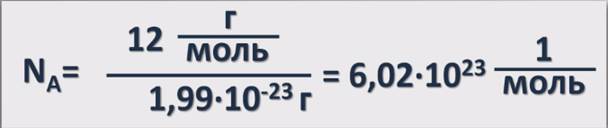
Если массу 1 моля углерода 12 г/моль разделить на массу 1 атома углерода 1,9910-23 г, то получится число, равное 6,02·1023. Поскольку это число обозначает количество частиц в 1 моле, единицы его пишут как 1/моль, моль-1 или обратный моль.
Чтобы как-то представить это число, скажем лишь, что оно больше, чем число стаканов воды, которое содержится в Мировом океане, а 6,02·1023 зёрен пшеницы имели бы массу порядка 2·1016 тонн.

Для сбора такого урожая потребовалось бы более 2 миллионов лет. Из примеров ясно: применение числа Авогадро для отсчета макротел бессмысленно. Главное его назначение – определение количества частиц (атомов и молекул) микромира и связь единиц микро и макромира.
Зная количество вещества, можно судить о числе частиц в определенной его порции и брать вещества для реакций в необходимых количествах. Таким образом, химики могут определять число атомов и молекул путём взвешивания порций веществ. Приведём примеры таких расчётов. Чтобы вычислить количество вещества, зная число частиц, используем формулу 2 где ν – количество вещества в молях, N – число частиц вещества, NА – постоянная Авогадро.
Задача.Какое количество вещества содержит 1,505·1023 молекул воды?
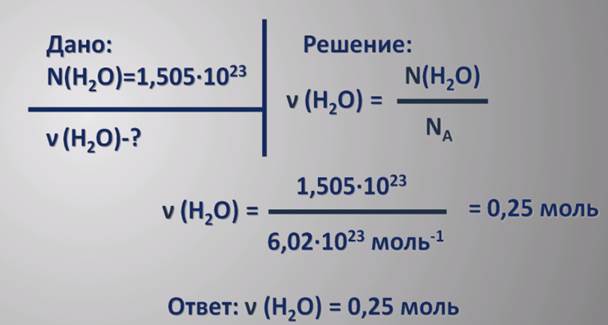
В химии редко используется такая величина как число частиц. Гораздо легче использовать величины, которые легко измерить. Такой величиной является масса вещества. Как же связаны между собой масса и количество вещества? Зная число молекул вещества в одном моле и массу одной молекулы, можно подсчитать массу одного моля вещества. Например, известно, что масса молекулы воды равна
2,992·10-23г. Умножив ее на постоянную Авогадро, 6,02·1023 обратных молей, мы получим
18 г/моль – массу одного моля воды или молярную массу воды.
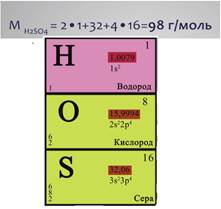
Молярной массой называется масса вещества, взятого в количестве 1 моль. Измеряется она в г/моль и обозначается латинской буквой М. Чтобы найти молярную массу вещества, нет необходимости проделывать столь сложные расчеты. Достаточно помнить, что молярная масса численно равна относительной молекулярной массе и имеет размерность г/моль.
Например, относительная молекулярная масса серной кислоты Н2SО4 равна 2·1+32+4·16=98, следовательно, молярная масса серной кислоты Н2SО4 равна 98 г/моль.
Молярную массу используют для перевода количества вещества в массу и наоборот. Для расчетов используют формулу: количество вещества ν равно отношению массы вещества m к молярной массе этого вещества М.
Решим задачу. Вычислить количество вещества азотной кислоты массой 75,6 г.

Если требуется найти массу, зная количество вещества, формулу преобразуют: масса вещества m равна произведению количества вещества ν на молярную массу этого вещества М.
Особенности молярной массы, молекулярной массы и обычной массы
Особенности молярной массы, молекулярной массы и обычной массы:
Количественно M = Mr равны, но они отличаются качественно.
Так как молярная масса (М) — это характеристика одного моль вещества, а молекулярная масса — характеристика одной молекулы.
Также молярная масса имеет свою единицу измерения: г/моль, в отличие от относительной и безразмерной молекулярной массы.
Зато, таким, образом, значение Mr легко подсмотреть через таблицу Менделеева (более крупное число в каждой ячейке (подробнее в данной теме)).
Например, 1 моль воды будет массой 18 грамм (16 грамм — кислород и по 1 грамму каждый водород). Т.е. мы взяли столько молекул воды (6,02*10 23 ), взвесили и получили 18 г.
Однако, следует помнить, что кислород обычно находится в виде молекулы O2, поэтому необходимо будет взять 2H2 (2 моль водорода) соединить с кислородом и получить: 2H2O.
Ну, а какая-нибудь серная кислота (H2SO4) в количестве 1 моль будет массой 98 грамм (1*2 + 32 + 4*16). Соответственно, молярная масса (M) серной кислоты 98 г/моль.
Поэтому, например, в формуле:
Мы видим, что у нас 1 моль метана (CH4), который имеет массу (12 (углерод) + 4*1(водород) = 16 г)
2 моль кислорода = 64 г (4*16)
1 моль углекислого газа = 44 г
2 моль воды = 36 г
Всё верно, закон сохранения массы работает.
Исходя из этого можно определить массовое соотношение.
Например, если нам предложили в задаче найти, сколько образуется грамм воды, если сжечь 32 г метана, то следуя расчетам по формуле выше, мы легко все рассчитаем и ответим, что 72 г воды.
Еще пример задачи: Сколько атомов азота и кислорода (определите в молях), в двух молях оксида азота (V)?
Посмотрим, что такое оксид азота(V) (с валентностью 5) — это N2O5
Значит, в одном моле оксида азота есть 2 моля азота и 5 молей кислорода. А в 2-х молях оксида азота всего в 2 раза больше: 4 моля азота и 10 молей кислорода.
Ответ: v(N) = 4 моль; v(N) = 10 моль
Самостоятельно еще раз проведите аналогию с мячами из прошлого урока, чтобы понять и запомнить все эти формулы и их вывод.
Теперь вы знаете основные формулы, из которых можно вывести вспомогательные для решения разных задач. Даже если точно не запомните формулы, просто следуйте аналогии с мячами и всё у вас получится.

Редактировать этот урок и/или добавить задание Добавить свой урок и/или задание
Добавить интересную новость
Добавить анкету репетитора и получать бесплатно заявки на обучение от учеников
user->isGuest) < echo (Html::a('Войдите', ['/user/security/login'], ['class' =>»]) . ‘ или ‘ . Html::a(‘зарегистрируйтесь’, [‘/user/registration/register’], [‘class’ => »]) . ‘ , чтобы получать деньги $$$ за каждый набранный балл!’); > else < if(!empty(Yii::$app->user->identity->profile->first_name) || !empty(Yii::$app->user->identity->profile->surname))< $name = Yii::$app->user->identity->profile->first_name . ‘ ‘ . Yii::$app->user->identity->profile->surname; > else < $name = ''; >echo ‘Получайте деньги за каждый набранный балл!’; > ?>—>
При правильном ответе Вы получите 1 балл
Относительная молярная и молекулярная массы вещества. Молярный объем вещества
где: К – коэффициент пропорциональности, равный 1г/моль.
В самом деле, для изотопа углерода 12 6С Аr = 12, а молярная масса атомов (по определению понятия «моль») равна 12г/моль. Следовательно, численные значения двух масс совпадают, а значит, К = 1. Отсюда следует, что молярная масса вещества, выраженная в граммах на моль, имеет то же численное значение, что и его относительная молекулярная (атомная) масса. Так, молярная масса атомарного водорода равна 1,008г/моль, молекулярного водорода – 2,016г/моль, молекулярного кислорода – 31,999г/моль.
Согласно закону Авогадро одно и то же число молекул любого газа занимает при одинаковых условиях один и тот же объем. С другой стороны, 1 моль любого вещества содержит (по определению) одинаковое число частиц. Отсюда следует, что при определенных температуре и давлении 1 моль любого вещества в газообразном состоянии занимает один и тот же объем.
Отношение объема, занимаемого веществом, к его к его количеству называется молярным объемом вещества. При нормальных условиях (101,325 кПа; 273 К) молярный объем любого газа равен 22,4 л/моль (точнее, Vn = 22,4 л/моль). Это утверждение справедливо для такого газа, когда другими видами взаимодействия его молекул между собой, кроме их упругого столкновения, можно пренебречь. Такие газы называют идеальными. Для неидеальных газов, называемых реальными, молярные объемы различны и несколько отличаются от точного значения. Однако в большинстве случаев различие сказывается лишь в четвертой и последующих значащих цифрах.
Измерения объемов газа обычно проводят при условиях, отличных от нормальных. Для приведения объема газа к нормальным условиям можно пользоваться уравнением, объединяющим газовые законы Бойля – Мариотта и Гей – Люссака:
где: V – объем газа при давлении p и температуре T;
V0 – объем газа при нормальном давлении p0 (101,325 кПа) и температуре T0 (273,15 К).
Молярные массы газов можно вычислить также, пользуясь уравнением состояния идеального газа – уравнением Клапейрона – Менделеева:
где: p – давление газа, Па;
V – его объем, м 3 ;
mB — масса вещества, г;
MB – его молярная масса, г/моль;
Т – абсолютная температура, К;
R – универсальная газовая постоянная, равная 8,314 Дж / (моль·К).
Если объем и давление газа выражены в других единицах измерения, то значение газовой постоянной в уравнении Клапейрона – Менделеева примет другое значение. Оно может быть рассчитано по формуле, вытекающей из объединенного закона газового состояния для моля вещества при нормальных условиях для одного моля газа:
Пример 1. Выразите в молях: а) 6,0210 21 молекул СО2; б) 1,2010 24 атомов кислорода; в) 2,0010 23 молекул воды. Чему равна молярная масса указанных веществ?
Решение. Моль – это количество вещества, в котором содержится число частиц любого определённого сорта, равное постоянной Авогадро. Отсюда, а) 6,0210 21 т.е. 0,01 моль; б) 1,2010 24 , т.е. 2 моль; в) 2,0010 23 , т.е. 1 /3 моль. Масса моля вещества выражается в кг/моль или г/моль. Молярная масса вещества в граммах численно равна его относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а.е.м.)
Так как молекулярные массы СО2 и Н2О и атомная масса кислорода соответственно равны 44; 18 и 16а.е.м.,то их молярные массы равны: а) 44г/моль; б) 18г/моль; в)16г/моль.
Пример 2. Вычислите абсолютную массу молекулы серной кислоты в граммах.
Решение. Моль любого вещества (см. пример 1) содержит постоянную Авогадро NA структурных единиц (в нашем примере молекул). Молярная масса H2SO4 равна 98,0 г/моль. Следовательно, масса одной молекулы 98/(6,02 10 23 ) = 1,63 10 -22 г.
Моля́рный объём — объём одного моля вещества, величина, получающаяся от деления молярной массы на плотность. Характеризует плотность упаковки молекул.
Значение NA = 6,022…×10 23 называется числом Авогадро в честь итальянского химика Амедео Авогадро. Это универсальная постоянная для мельчайших частиц любого вещества.
Именно такое количество молекул содержит 1 моль кислорода О2, такое же количество атомов в 1 моле железа (Fe), молекул в 1 моле воды H2O и т. д.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях имеет один и тот же объём Vm = 22,413 996(39) л [1] . При нормальных условиях большинство газов близки к идеальным, поэтому вся справочная информация о молярном объёме химических элементов относится к их конденсированным фазам, если не оговорено обратно
Основные положения молекулярно-кинетической теории (МКТ), формулы МКТ
Статья посвящена основам молекулярно-кинетической теории, ее основным положениям и формулам, применяемым для описания состава и строения вещества.
Молекулярно-кинетическая теория (МКТ) изучает строение и свойства вещества, исходя из предположения, что атомы и молекулы — это его мельчайшие частицы.
Основные положения Молекулярно-кинетической теории
- Вещество (материя) состоит из частиц — атомов и молекул.
- Все частицы беспорядочно передвигаются в пространстве.
- Атомы и молекулы, составляющие вещество, взаимодействуют друг с другом путем абсолютно упругих столкновений. Силы, с которыми они взаимодействуют имеют электрическую природу. Гравитационное притяжение между частицами пренебрежимо мало.
Доказательством теории служат многочисленные опыты с начала XX столетия Отто Штерна (1888 – 1969), Жана Перрена (1870 – 1942), изучавшего броуновское движение («хаотичное движение наблюдаемых под микроскопом твердых частиц в жидкости», открыто Робертом Броуном в 1827 году), а также современные эксперименты, производимые на высокотехнологичном оборудовании (рентгеновская дифрактометрия, электронная микроскопия).
Основы МКТ на языке формул
Для определения строения веществ оперируют такими понятиями, как относительная молекулярная и молярная массы, количество вещества.
Относительная молекулярная (или атомная) масса вещества
Относительная молекулярная масса (Mr) показывает во сколько раз масса искомого атома или молекулы отличается от одной двенадцатой части массы атома углерода.

m0 – масса молекулы (или атома) данного вещества [кг],
m0С – масса атома углерода [кг].
*Относительные атомные массы всех веществ указаны в периодической таблице Д.И. Менделеева.
Количество вещества
Количество вещества (ν) — отношение числа частиц в данном ограниченном пространстве к числу молекул в одном моле вещества. Моль — это количество вещества, состоящее из такого же количества структурных единиц, какое содержится в 12 граммах углерода (С 12 ).

Единицы измерения ν = [моль].
N – число частиц (молекул) в данном ограниченном теле (безразмерная величина);
NA – число молекул в одном моле вещества (постоянная Авогадро) [моль -1 ].
NA = 6,02 · 10 23 моль -1 – постоянная Авогадро.
Из-за неудобства работы с числом частиц количество вещества часто выражают также через молярную массу:

где m – масса любого количества вещества [кг],
μ – молярная масса [кг · моль-1].
Молярная масса
Молярная масса (μ) показывает массу одного моля вещества.

Единица измерения μ = [кг · моль-1].
Связь молярной и относительной молекулярной массы

Относительная молекулярная масса примерно в тысячу раз больше молярной.

Понравилась статья, расскажите о ней друзьям:



:max_bytes(150000):strip_icc()/KaylaDube-d1b0fdb0e7704d5697568c25cda4350b-d6299b7e4de84ddea274b57b2124ba5e.jpeg)