Цинк: характеристика, свойства, особенности металла
Цинк — свойства, характеристики и применение элемента

Цинк давно зарекомендовал себя как важный химический элемент. Еще до нашей эры люди знали о нем многое и широко применяли в различных сферах. Свойства этого материала позволяют использовать цинк во многих отраслях и в быту. Материал с успехом применяют в химической промышленности, в машиностроении и в строительстве. Поэтому сегодня мы рассмотрим полезные свойства и характеристика металла цинка и сплавов на его основе, цену за кг, особенности использования, а также изготовления материала.
Природное образование и конечное формирование
Аналогично многим другим металлам, цинк в природе не встречается в чистом виде. Как правило, этот химический элемент присутствует в минералах, сочетаясь с другими элементами, и присутствует как:
- оксид,
- силикат,
- карбонат.
Можно сказать, это традиционная цинковая составляющая. Поэтому, чтобы воспроизвести чистый металл, придётся прибегнуть к переработке сырья цинксодержащего минерала, процедуре, которая предполагает многоступенчатый процесс очистки (включающий несколько отдельных физических и химических этапов).
 Природный минерал, содержащий высокий процент химического вещества, широко используемого для самых разных целей. Структура минерала напоминает кварцевые образования характерными вкраплениями-блёстками
Природный минерал, содержащий высокий процент химического вещества, широко используемого для самых разных целей. Структура минерала напоминает кварцевые образования характерными вкраплениями-блёстками
Например, для переработки сульфида цинка необходимо измельчить сырьё в порошок, и тщательно промыть, чтобы избавиться от сульфидов других металлов, присутствующих в виде примесей. В конечном итоге получается оксид цинка (ZnO). Выщелачиванием (реакция с серной кислотой) получают раствор сульфата.
Затем используется электролиз (электрохимический процесс) для отделения чистого химического элемента. Также допустимо воспроизводить металл из минерального сырья путём плавки (нагревания углеродом), что традиционно и применяется в промышленном секторе.
Что такое цинк
Понятие и особенности
Для начала вашему вниманию предлагается общая характеристика цинка. Этот продукт является не только необходимым производственным металлом, но и важным биологическим элементом. В любом живом организме он присутствует до 4 % от всех элементов.Самые богатые месторождения цинка это Боливия, Иран, Казахстан и Австралия. В нашей стране одним из крупных производителей считается предприятие ОАО «ГМК Дальполиметалл».
Если рассматривать цинк со стороны периодической системе Менделеева, то он относится к переходным металлам и имеет следующие характеристики:
- Номер по порядку: 30
- Масса: 65,37.
- Степень окисления — +2.
- Цвет: синевато-белый.
Цинк – это радиоактивный изотоп, для которого характерен период полураспада 244 дня.
Если рассматривать цинк со стороны простого вещества, то этот материал имеет следующие характеристики:
- Вид материала – металл.
- Цвет – серебристо-голубой.
- Покрытие – защищен оксидной пленкой, под которой скрывается блеск и сияние.
Цинк содержится в коре земли. Доля металла в ней не очень большая: всего 0,0076%.
Как единичного материала цинка не существует. Он входит в состав многих руд и минералов.
- Наиболее распространенными являются: цинковая обманка, клейофан, марматит. Кроме этого, цинк можно встретить в следующих природных материалах: вюртцит, франкленит, цинкит, смитсонит, каламин, виллемит.
- Спутниками цинка обычно являются: германий, кадмий, таллий, галлий, индий, кадмий.
- Наиболее популярными являются сплавы цинка и алюминия, меди, олова, никеля.
О роли цинка в нашей жизни расскажут специалист в этом видео:
Металлы-конкуренты
С цинком могут конкурировать только 4 металла: титан, алюминий, хром и медь. Описанные материалы имеют следующие характеристики:
- Алюминий: серебристо-белый цвет, хорошо проводит электричество и тепло, поддается обработке давлением, устойчив к коррозии, имеет низкую плотность, применяется в процессе производства стали (для повышения жаростойкости).
- Титан: серебристо-белый цвет, большая температура плавления, при соприкосновении с воздухом окисляется, низкая теплопроводность, легко поддается ковке и штамповке, при высокой температуре на поверхности образуется прочная защитная пленка.
- Хром: синевато-блестящий цвет, высокая твердость, хрупкость, стойкость к окислению в условиях атмосферы и воды, используется для декоративного покрытия.
- Медь: красный металл, имеет высокую пластичность, хорошую электропроводность, высокую теплопроводность, стойкость к коррозионным процессам, применяется в кровельных материалах.
Для строительных целей наиболее часто (кроме цинка) применяют и другие цветные металлы. К ним относятся: бронза, латунь, силумин, баббит, дюралюминий и несколько других.
Цинк отличается от прочих металлов тем, что легко поддается деформации при температуре от 100 ºС до 150 ºС. В таком температурном диапазоне цинк так же поддается ковке и прокату в тонкие листы.
Плюсы и минусы
- Хорошая жидкотекучесть, благодаря чему легко заполняются литейные формы.
- Высокая пластичность во время проката.
- Чистый цинк хорошо поддается ковке.
- Благодаря своим свойствам и воздействию температуры способен принимать различные состояния.
- Отлично защищает изделие от коррозии, благодаря чему охотно пользуется спросом в строительстве и машиностроении.
- При нагреве вместе с фосфором или серой может взорваться.
- На воздухе теряет блеск.
- При комнатной температуре имеет маленькую пластичность.
- Не находится в природе в чистом виде.
Масса, механические, химические и физические свойства цинка, его основные характеристики будут рассмотрены нами ниже.
СТРУКТУРА
Кристаллы цинка имеют гексагональную упаковку атомов. Но в отличие от плотнейшей гексагональной упаковки сферических атомов решетки цинка вытянуты в одном направлении. Каждый атом окружен шестью другими атомами, лежащими в одной плоскости или слое. Расстояние между центрами соседних атомов в этом плоском слое а равно 0,26649 нм. Внешняя электронная конфигурация атома 3d104s2. Не полиморфен.
Атомная и молекулярная масса цинка
Относительной молекулярная масса вещества (Mr) – это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (Ar) — во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.
Поскольку в свободном состоянии цинк существует в виде одноатомных молекул Zn, значения его атомной и молекулярной масс совпадают. Они равны 65,38.
Изотопы цинка
Известно, что в природе хром может находиться в виде пяти стабильных изотопов 64Zn, 66Zn, 67Zn, 68Zn и 70Zn. Их массовые числа равны 64, 66, 67, 68 и 70 соответственно. Ядро атома изотопа цинка 64Zn содержит тридцать протонов и тридцать четыре нейтрона, а остальные изотопы отличаются от него только числом нейтронов.
Существуют искусственные нестабильные изотопы цинка с массовыми числами от 54-х до 83-х, а также десять изомерных состояний ядер, среди которых наиболее долгоживущим изотопом является 65Zn с периодом полураспада равным 243,66 суток.
ПРОИСХОЖДЕНИЕ
Цинк в природе как самородный металл не встречается. Известно 66 минералов цинка, в частности цинкит, сфалерит, виллемит, каламин, смитсонит, франклинит. Наиболее распространенный минерал — сфалерит, или цинковая обманка. Основной компонент минерала — сульфид цинка ZnS, а разнообразные примеси придают этому веществу всевозможные цвета. Из-за трудности определения этого минерала его называют обманкой (др.-греч. σφαλερός — обманчивый). Цинковую обманку считают первичным минералом, из которого образовались другие минералы элемента № 30: смитсонит ZnCO3, цинкит ZnO, каламин 2ZnO · SiO2 · Н2O. На Алтае нередко можно встретить полосатую «бурундучную» руду — смесь цинковой обманки и бурого шпата. Кусок такой руды издали действительно похож на затаившегося полосатого зверька.
Ионы цинка
На внешнем энергетическом уровне атома цинка имеется два электрона, которые являются валентными:
В результате химического взаимодействия цинк отдает свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион:
Изготовление и применение чистого металла
Многие виды повседневных хозяйственных вещей оцинкованы. Например:
- металлические крыши сооружений,
- водосточные желоба зданий,
- резервуары для воды и т.д.
Достаточно большая доля цинка используется в конструкциях одноразовых цинк-углеродистых не перезаряжаемых аккумуляторов. Процесс изготовления латуни также требует значительных объёмов этого вещества.
Характерной особенностью цинка является образование целого ряда полезных соединений:
- Сульфид (люминофор экранов старых телевизоров, осциллографов, люминесцентные лампы и светящиеся краски);
- Сульфат (защитные средства от сорняков, применение в текстильном производстве);
- Оксид (используется для изготовления резины, способствует улучшению свойств пластмасс, красок, чернила, бетона, косметики).
Многие известные сплавы формируются на цинковой составляющей. Например, латунь, зубная амальгама, бронза и некоторые виды припоев. Оцинковка не только предотвращает ржавление резервуаров для воды. Практически все виды лекарств от кашля и простуды, витаминные таблетки и добавки никак не обходятся без этого вещества.
 Часто встречающиеся таблетки (капсулы) биологических добавок включают добавки кальция для укрепления зубов и костей, витамин «С», омега-3 для глаз, а также цинк для усиления иммунитета
Часто встречающиеся таблетки (капсулы) биологических добавок включают добавки кальция для укрепления зубов и костей, витамин «С», омега-3 для глаз, а также цинк для усиления иммунитета
Дефицит цинка в организме сопровождается различными проблемами по отношению к здоровью организма, приводит к развитию болезней. Правда, в основном эта проблема характерна для развивающихся стран, где отмечаются факторы недоедания населения, недостаток сбалансированного полезного питания.
Молекула и атом цинка
В свободном состоянии цинк существует в виде одноатомных молекул Zn. Приведем некоторые свойства, характеризующие атом и молекулу цинка:
Цинк и его сплавы: химический состав, физические свойства, применение

Цинк — хрупкий голубовато-белый металл. В природе без примесей не встречается. В 1738 году Уильям Чемпион добыл чистые пары цинка с помощью конденсации. В периодической системе Менделеева находится под номером 30 и обозначается символом Zn.
Свойства цинка
Химические свойства цинка
Цинк — активный металл. При комнатной температуре тускнеет и покрывается слоем оксида цинка.
- Вступает в реакцию со многими неметаллами: фосфором, серой, кислородом.
- При повышении температуры взаимодействует с водой и сероводородом, выделяя водород.
- При сплавлении с щелочами образует цинкаты — соли цинковой кислоты.
- Реагирует с серной кислотой, образуя различные вещества в зависимости от концентрации кислоты.
- При сильном нагревании вступает в реакции со многими газами: газообразным хлором, фтором, йодом.
- Не реагирует с азотом, углеродом и водородом.
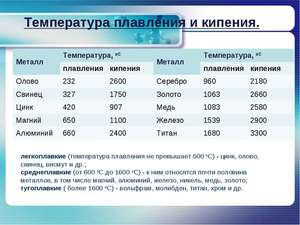
Физические свойства цинка
Цинк — твердый металл, но становится пластичным при 100–150 °C. При температуре выше 210 °С может деформироваться. Температура плавления — очень низкая для металлов. Несмотря на это, цинк имеет хорошую электропроводность.
- Плотность — 7,133 г/см³.
- Теплопроводность — 116 Вт/(м·К).
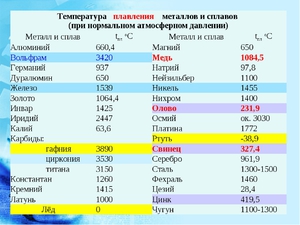
- Температура плавления цинка — 419,6 °C.
- Температура кипения — 906,2 °C.
- Удельная теплота испарения — 114,8 кДж/моль.
- Удельная теплота плавления — 7,28 кДж/моль.
- Удельная магнитная восприимчивость — 0,175·10-6.
- Предел прочности при растяжении — 200–250 Мн/м 2 .
Подробный химический состав цинка различных марок указан в таблице ниже.
| Обозначение марок | Цинк, не менее | Примесь, не более | |||||||
| свинец | кадмий | железо | медь | олово | мышьяк | алюминий | всего | ||
| ЦВ00 | 99,997 | 0,00001 | 0,002 | 0,00001 | 0,00001 | 0,00001 | 0,0005 | 0,00001 | 0,003 |
| ЦВ0 | 99,995 | 0,003 | 0,002 | 0,002 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,005 |
| ЦВ | 99,99 | 0,005* | 0,002 | 0,003 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,01 |
| Ц0А | 99,98 | 0,01 | 0,003 | 0,003 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,02 |
| Ц0 | 99,975 | 0,013 | 0,004 | 0,005 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,025 |
| Ц1 | 99,95 | 0,02 | 0,01 | 0,01 | 0,002 | 0,001 | 0,0005 | 0,005 | 0,05 |
| Ц2 | 98,7 | 1,0 | 0,2 | 0,05 | 0,005 | 0,002 | 0,01 | 0,010** | 1,3 |
| Ц3 | 97,5 | 2,0 | 0,2 | 0,1 | 0,05 | 0,005 | 0,01 | — | 2,5 |
| * В цинке, применяемом для производства сплава марки ЦАМ4-1о, массовая доля свинца должна быть не более 0,004%. ** В цинке, применяемом для проката, массовая доля алюминия должна быть не более 0,005%. | |||||||||
Содержание примесей в цинке зависит от способа производства и качества сырья.
В России основной процент цинка получают гидрометаллургическим способом — металл восстанавливают из солей в растворах. Такой способ позволяет получить наиболее чистый металл. Но часть цинка обрабатывают при высоких температурах. Такой метод называют пирометаллургическим.
Свинец — особая примесь в цинке, так как основная его часть оседает из-за нерастворимых анодов, содержащихся в металле. Катодный цинк, помимо всех указанных примесей, состоит из хлора и фтора.
Как примеси изменяют свойства цинка
Производители ограничивают содержание кадмия, олова и свинца в литейных сплавах цинка, чтобы подавить межкристаллитную коррозию.
Олово — вредная примесь. Металл не растворяется и выделяется из расплава — способствует ломкости цинковых отливок. Кадмий напротив — растворяется в цинке и снижает его пластичность в горячем состоянии. Свинец увеличивает растворимость металла в кислотной среде.
Железо повышает твердость цинка, но снижает его прочность. Вместе с тем оно усложняет процесс заполнения форм при литье.
Медь увеличивает твердость цинка, но уменьшает его пластичность и стойкость при коррозии. Содержание меди также мешает рекристаллизации цинка.
Наиболее вредная примесь — мышьяк. Даже при небольшом ее количестве металл становится хрупким и менее пластичным.
Чтобы избежать растрескивания кромок при горячей прокатке цинка, содержание сурьмы не должна быть выше 0,01%. В горячем состоянии она увеличивает твердость цинка, лишая его хорошей пластичности.
Сплавы цинка
Сплавы на цинковой основе с добавлением меди, магния и алюминия имеют низкую температуру плавления и обладают хорошей текучестью. Они легко поддаются обработке, свариванию и паянию.
Латунь
Различают латуни двухкомпонентные и многокомпонентные.
Двухкомпонентная латунь — сплав цинка с высоким содержанием меди. Существует желтая латунь с медью в количестве 67%, золотистая медь или томпак — 75%, и зеленая — 60%. Такие сплавы могут деформироваться при температуре 300 °C.
Многокомпонентные латуни, помимо 2-х основных металлов, состоят из других добавок: никеля, железа, свинца или марганца. Каждый из элементов влияет на свойства сплава.
ЦАМ — семейство цинковых сплавов. В их состав входят магний, алюминий и медь. Такие сплавы цинка используются в литейном производстве. В них содержится алюминий в количестве 4%.
Основная область применения сплавов ЦАМ — литье цинка под давлением. Сплавы этого семейства обладают низкой температурой плавления и хорошими литейными свойствами. Их высокопрочность позволяет производить прочные и сложные детали.
Вирениум
Сплав состоит из цинка (24,5%), меди (70%), никеля (5,5%).
Производств цинка
Добыча металла
Цинк как самородный металл в природе не встречается. Добывается из полиметаллических руд, содержащих 1–4% металла в виде сульфида, а также меди, свинца, золота, серебра, висмута и кадмия. Руды обогащаются селективной флотацией и получаются цинковые концентраты (50–60% Zn).

Концентраты цинка обжигают в печах. Сульфид цинка переводится в оксид ZnO. При этом выделяется сернистый газ SO2, который используется в производстве серной кислоты.
Получение металла
Существуют два способа получения чистого цинка из оксида ZnO.
Самый древний метод — дистилляционный. Обожженный концентрированный состав подвергают термообработке, чтобы придать ему зернистость и газопроницаемость.
Затем концентрат восстанавливают коксом или углем при температуре 1200–1300 °C. В процессе образуются пары металла, которые конденсируют и разливают в изложницы. Жидкий металл отстаивают от железа и свинца при температуре 500 °C. Так достигается цинк чистотой 98,7%.
Иногда используется сложная и дорогая обработка цинка ректификацией — разделением смесей за счет обмена теплом между паром и жидкостью. Такая чистка позволяет получить металл чистотой 99,995% и извлечь кадмий.
Второй метод производства цинка — электролитический. Обожженный концентрат обрабатывается серной кислотой. Готовый сульфатный раствор очищается от примесей, после чего подвергается электролизу в свинцовых ваннах. Цинк дает осадок на алюминиевых катодах. Полученный металл удаляют с ванн и плавят в индукционных печах. После этого получается электролитный цинк чистотой 99,95%.
Литье металла
Горячий цинк — жидкий и текучий металл. Благодаря таким свойствам он легко заполняется в литейные формы.
Примеси влияют на величину натяжения поверхности цинка. Технологические свойства металла можно улучшить, добавив небольшое количество лития, магния, олова, кальция, свинца или висмута.

Чем выше температура перегрева цинка, тем лучше он заполняет формы. При литье металла в чугунные изложницы его объем уменьшается на 1,6%. Это затрудняет получение крупных и длинных цинковых отливок.
Применение цинка
Для защиты металлов от коррозии
Чистый цинк используется для защиты металлов от коррозии. Основу покрывают тонкой пленкой. Этот процесс называется металлизацией.
В автомобильной отрасли
Сплавы на цинковой основе используют для оформления декора автомобильного салона, в производстве ручек дверей, замков, зеркал и корпусов стеклоочистителей.
В автомобильные покрышки добавляют окись цинка, которая повышает качество резины.
В батарейках, аккумуляторах и других химических источниках тока цинк используется как материал для отрицательного электрода. В производстве электромобилей применяются цинк-воздушные аккумуляторы, которые обладают высокой удельной энергоемкостью.
В производстве ювелирных украшений
Ювелиры добавляют цинк в сплавы на основе золота. В итоге они легко поддаются ковке и становятся пластичными — прочно соединяют мелкие детали изделия между собой.
Металл также осветляет ювелирные изделия, поэтому его часто используют в изготовлении белого золота.
В медицине
Окись цинка применяется в медицине как антисептическое средство. Окись добавляют в мази и другие составы для заживления ран.
Благодаря своим свойствам, цинк широко применяется в различных областях промышленности. Металл пользуется спросом из-за относительно низкой цены и хороших физических свойств.
Цинк в строительстве: особенности металла, его плюсы и минусы

Цинк давно зарекомендовал себя как важный химический элемент. Еще до нашей эры люди знали о нем многое и широко применяли в различных сферах. Свойства этого материала позволяют использовать цинк во многих отраслях и в быту. Материал с успехом применяют в химической промышленности, в машиностроении и в строительстве. Поэтому сегодня мы рассмотрим полезные свойства и характеристика металла цинка и сплавов на его основе, цену за кг, особенности использования, а также изготовления материала.
Что такое цинк
Понятие и особенности
Для начала вашему вниманию предлагается общая характеристика цинка. Этот продукт является не только необходимым производственным металлом, но и важным биологическим элементом. В любом живом организме он присутствует до 4 % от всех элементов.Самые богатые месторождения цинка это Боливия, Иран, Казахстан и Австралия. В нашей стране одним из крупных производителей считается предприятие ОАО «ГМК Дальполиметалл».
Если рассматривать цинк со стороны периодической системе Менделеева, то он относится к переходным металлам и имеет следующие характеристики:
- Номер по порядку: 30
- Масса: 65,37.
- Степень окисления — +2.
- Цвет: синевато-белый.
Если рассматривать цинк со стороны простого вещества, то этот материал имеет следующие характеристики:
- Вид материала – металл.
- Цвет – серебристо-голубой.
- Покрытие – защищен оксидной пленкой, под которой скрывается блеск и сияние.
Цинк содержится в коре земли. Доля металла в ней не очень большая: всего 0,0076%.
Как единичного материала цинка не существует. Он входит в состав многих руд и минералов.
- Наиболее распространенными являются: цинковая обманка, клейофан, марматит. Кроме этого, цинк можно встретить в следующих природных материалах: вюртцит, франкленит, цинкит, смитсонит, каламин, виллемит.
- Спутниками цинка обычно являются: германий, кадмий, таллий, галлий, индий, кадмий.
- Наиболее популярными являются сплавы цинка и алюминия, меди, олова, никеля.
О роли цинка в нашей жизни расскажут специалист в этом видео:
Металлы-конкуренты
С цинком могут конкурировать только 4 металла: титан, алюминий, хром и медь. Описанные материалы имеют следующие характеристики:
- Алюминий: серебристо-белый цвет, хорошо проводит электричество и тепло, поддается обработке давлением, устойчив к коррозии, имеет низкую плотность, применяется в процессе производства стали (для повышения жаростойкости).
- Титан: серебристо-белый цвет, большая температура плавления, при соприкосновении с воздухом окисляется, низкая теплопроводность, легко поддается ковке и штамповке, при высокой температуре на поверхности образуется прочная защитная пленка.
- Хром: синевато-блестящий цвет, высокая твердость, хрупкость, стойкость к окислению в условиях атмосферы и воды, используется для декоративного покрытия.
- Медь: красный металл, имеет высокую пластичность, хорошую электропроводность, высокую теплопроводность, стойкость к коррозионным процессам, применяется в кровельных материалах.
Для строительных целей наиболее часто (кроме цинка) применяют и другие цветные металлы. К ним относятся: бронза, латунь, силумин, баббит, дюралюминий и несколько других.
Плюсы и минусы
 Плюсы:
Плюсы:
- Хорошая жидкотекучесть, благодаря чему легко заполняются литейные формы.
- Высокая пластичность во время проката.
- Чистый цинк хорошо поддается ковке.
- Благодаря своим свойствам и воздействию температуры способен принимать различные состояния.
- Отлично защищает изделие от коррозии, благодаря чему охотно пользуется спросом в строительстве и машиностроении.
- При нагреве вместе с фосфором или серой может взорваться.
- На воздухе теряет блеск.
- При комнатной температуре имеет маленькую пластичность.
- Не находится в природе в чистом виде.
Масса, механические, химические и физические свойства цинка, его основные характеристики будут рассмотрены нами ниже.
Свойства и характеристики
Итак, какими свойствами обладает цинк?
Физические
- Является металлом средней твердости.
- Цинк не имеет полиморфных модификаций.
- Холодный цинк становится хрупким металлом.
- Приобретает пластичность при температуре 100-100 ºС.
- При более высокой температуре в 250 ºС снова превращается в хрупкий металл.
- Температура плавления твердого цинка равна 419,5 ºС.
- Температура перехода в пар – 913ºС.
- Температура кипения равна 906 ºС.
- Плотность цинка в твердом состоянии равна 7,133 г/см 3 , в жидком — 6, 66 г/см 3.
- Относительное удлинение 40-50%.
- Легко растворим в кислотах.
- Легко растворим в щелочах.
О том, как правильно плавить цинк, смотрите в видеоролике:
Химические
Химические свойства цинка:
- 3d 10 4s 2 — конфигурация атома.
- Цинк считается активным металлом.
- Является энергетическим восстановителем.
- Электродный потенциал: -0,76 В.
- При температуре ниже 100 ºС теряет блеск и имеет покрытие пленкой.
- Во влажном воздухе (особенно если в нем есть углекислый газ) металл разрушается.
- Во время сильного нагрева цинк сильно сгорает с образованием голубоватого пламя.
- Степень окисления: .
- Кислоты и щелочи действуют на цинк различно в зависимости от присутствия в металле различных примесей.
- При нагревании цинка в воде происходит процесс гидролизации с образованием белого осадка.
- Минеральные кислоты большой силы способны легко растворить цинк.
Структура и состав
 Формула цинка следующая: Zn. Конфигурация внешнего слоя атома — 4s 2 . Цинк имеет химическую связь металлическую, кристаллическую решетку – гексагональную, плотную.
Формула цинка следующая: Zn. Конфигурация внешнего слоя атома — 4s 2 . Цинк имеет химическую связь металлическую, кристаллическую решетку – гексагональную, плотную.
Цинк в природе состоит их трех стабильных изотопов (перечислим их: 64 Zn (48,6%), 66 Zn (26,9%) и 67 Zn (4,1%)) и нескольких радиоактивных. Самый важный из радиоактивных имеет полураспад равный 244 суткам.
Производство
Как говорилось, цинк не содержится в природе в чистом виде. Его в основном получают из полимерных руд. В этих рудах цинк присутствует в форме сульфида. С ним всегда идут сопутствующие металлы, перечисленные выше.
С помощью процесса обогащения селективной флотацией получают концентрат цинка. Параллельно этому процессу из полиметаллических руд выходят другие концентраты веществ. Например, свинцовые и медные.
Полученные цинковые концентраты обжигают в печи. В результате действия высоких температур цинк переходит из сульфидного состояния в оксидное. В процессе производства выделяется сернистый газ, который идет на производство серной кислоты. Чистый цинк получают из оксида цинка двумя способами: пирометаллургическим и электролитическим.
- Пирометаллургический способ имеет очень давнюю историю. Концентрат обжигают и подвергают процессу спекания. Затем цинк восстанавливают с применение угля или кокса. Цинк, полученный этим способом, доводят до чистого состояния с помощью отстаивания.
- При электролитическом способе концентрат цинка обрабатывают с помощью серной кислоты. В результате получается раствор, который подвергают процессу электролиза. Здесь цинк осаждается и его подвергают плавлению в специальных печах.
Области применения
Цинк, как элемент, содержится в достаточном количестве в земной коре и в водных ресурсах.
- При производстве масляных красок.
- При изготовлении резиновых шин.
- В медицине.
- Способен восстанавливать благородные металлы.
- Применяется в качестве защитного средства от коррозии.
- Используется в полиграфической промышленности.
- Применяется при изготовлении аккумуляторов.
Половина всего производства цинка идет на выполнение функции «защита от коррозии». Благодаря свои свойством из цинка с успехом отливают ответственные детали (например, для самолетов). Цинк широко применяется совместно с медью и свинцом.
Цинк так же использует в виде порошка для осуществления ряда химико-технологических процессов.
О том, как снять цинк, вам поведает данное видео:
Цинк: характеристика, свойства, особенности металла
Цинк (лат. Zincum), Zn, химический элемент II группы периодической системы Менделеева; атомный номер 30, атомная масса 65,38, синевато-белый металл. Известно 5 стабильных изотопов с массовыми числами 64, 66, 67, 68 и 70; наиболее распространен 64 Zn (48,89%). Искусственно получен ряд радиоактивных изотопов, среди которых наиболее долгоживущий 65 Zn с периодом полураспада Т½ = 245 сут; применяется как изотопный индикатор.
Историческая справка. Сплав Цинка с медью — латунь — был известен еще древним грекам и египтянам. Чистый Цинк долгое время не удавалось выделить. В 1746 году А. С. Маргграф разработал способ получения металла прокаливанием смеси его оксида с углем без доступа воздуха в глиняных огнеупорных ретортах с последующей конденсацией паров Цинка в холодильниках. В промышленном масштабе выплавка Цинка началась в 17 веке.
Распространение Цинка в природе. Среднее содержание Цинк в земной коре (кларк) — 8,3·10 -3 % по массе, в основных изверженных породах его несколько больше (1,3·10 -2 %), чем в кислых (6·10 -3 %). Известно 66 минералов Цинка, важнейшие из них — цинкит, сфалерит, виллемит, каламин, смитсонит, франк-линит ZnFe2O4. Цинк — энергичный водный мигрант; особенно характерна его миграция в термальных водах вместе с Рb; из этих вод осаждаются сульфиды Цинка, имеющие важное промышленное значение. Цинк также энергично мигрирует в поверхностных и подземных водах; главным осадителем для него является H2S, меньшую роль играет сорбция глинами и другие процессы. Цинк — важный биогенный элемент; в живом веществе содержится в среднем 5·10 -4 % Цинка, но имеются и организмы-концентраторы (например, некоторые фиалки).
Физические свойства Цинка. Цинк — металл средней твердости. В холодном состоянии хрупок, а при 100-150 °С весьма пластичен и легко прокатывается в листы и фольгу толщиной около сотых долей миллиметра. При 250 °С вновь становится хрупким. Полиморфных модификаций не имеет. Кристаллизуется в гексагональной решетке с параметрами а = 2,6594Å, с = 4,9370Å. Атомный радиус 1,37Å; ионный Zn 2+ -0,83Å. Плотность твердого Цинка 7,133 г/см 3 (20 °С), жидкого 6,66 г/см 3 (419,5 °С); tпл 419,5 °С; tкип 906 °С. Температурный коэффициент линейного расширения 39,7·10 -3 (20-250 °С), коэффициент теплопроводности 110,950 вт/(м ·К) 0,265 кал/см·сек·°С (20 °С), удельное электросопротивление 5,9·10 -6 ом·см (20 °С), удельная теплоемкость Цинка 25,433 кдж/(кг·К.) [6,07 кал/(г·°С)]. Предел прочности при растяжении 200-250 Мн/м 2 (2000-2500 кгс/см 2 ), относительное удлинение 40-50%, твердость по Бринеллю 400-500 Мн/м 2 (4000-5000 кгс/см 2 ). Цинк диамагнитен, его удельная магнитная восприимчивость -0,175·10 -6 .
Химические свойства Цинка. Внешняя электронная конфигурация атома Zn 3d 10 4s 2 . Степень окисления в соединениях +2. Нормальный окислительно-восстановительный потенциал, равный 0,76 в, характеризует Цинк как активный металл и энергичный восстановитель. На воздухе при температуре до 100 °С Цинк быстро тускнеет, покрываясь поверхностной пленкой основных карбонатов. Во влажном воздухе, особенно в присутствии СО2, происходит разрушение металла даже при обычных температурах. При сильном нагревании на воздухе или в кислороде Цинк интенсивно сгорает голубоватым пламенем с образованием белого дыма оксида цинка ZnO. Сухие фтор, хлор и бром не взаимодействуют с Цинком на холоду, но в присутствии паров воды металл может воспламениться, образуя, например, ZnCl2. Нагретая смесь порошка Цинка с серой дает сульфид Цинк ZnS. Сульфид Цинк выпадает в осадок при действии сероводорода на слабокислые или аммиачные водные растворы солей Zn. Гидрид ZnH2 получается при взаимодействии LiАlН4 с Zn(CH3)2 и других соединениями Цинка; металлоподобное вещество, разлагающееся при нагревании на элементы. Нитрид Zn3N2 — черный порошок, образуется при нагревании до 600 °С в токе аммиака; на воздухе устойчив до 750 °С, вода его разлагает. Карбид Цинка ZnC2 получен при нагревании Цинка в токе ацетилена. Сильные минеральные кислоты энергично растворяют Цинк, особенно при нагревании, с образованием соответствующих солей. При взаимодействии с разбавленной НCl и H2SO4 выделяется Н2, а с НNО3 — кроме того, NO, NO2, NH3. С концентрированной НCl, H2SO4 и HNO3 Цинк реагирует, выделяя соответственно Н2, SO2, NO и NO2. Растворы и расплавы щелочей окисляют Цинк с выделением Н2 и образованием растворимых в воде цинкитов. Интенсивность действия кислот и щелочей на Цинк зависит от наличия в нем примесей. Чистый Цинк менее реакционноспособен по отношению к этим реагентам из-за высокого перенапряжения на нем водорода. В воде соли Цинка при нагревании гидролизуются, выделяя белый осадок гидрооксида Zn(OH)2. Известны комплексные соединения, содержащие Цинк, например [Zn(NH3)4]SО4 и другие.
Получение Цинка. Цинк добывают из полиметаллических руд, содержащих 1-4% Zn в виде сульфида, а также Cu, Pb, Ag, Аu, Cd, Bi. Руды обогащают селективной флотацией, получая цинковые концентраты (50-60% Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты. Цинковые концентраты обжигают в печах в кипящем слое, переводя сульфид Цинка в оксид ZnO; образующийся при этом сернистый газ SO2 расходуется на производство серной кислоты. От ZnO к Zn идут двумя путями. По пирометаллургическому (дистилляционному) способу, существующему издавна, обожженный концентрат подвергают спеканию для придания зернистости и газопроницаемости, а затем восстанавливают углем или коксом при 1200-1300 °С: ZnO + С = Zn + CO. Образующиеся при этом пары металла конденсируют и разливают в изложницы. Сначала восстановление проводили только в ретортах из обожженной глины, обслуживаемых вручную, позднее стали применять вертикальные механизированные реторты из карборунда, затем — шахтные и дуговые электропечи; из свинцово-цинковых концентратов Цинк получают в шахтных печах с дутьем. Производительность постепенно повышалась, но Цинк содержал до 3% примесей, в т. ч. ценный кадмий. Дистилляционный Цинк очищают ликвацией (т. е. отстаиванием жидкого металла от железа и части свинца при 500 °С), достигая чистоты 98,7%. Применяющаяся иногда более сложная и дорогая очистка ректификацией дает металл чистотой 99,995% и позволяет извлекать кадмий.
Основной способ получения Цинка — электролитический (гидрометаллургический). Обожженные концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Цинк осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах. Обычно чистота электролитного Цинка 99,95%, полнота извлечения его из концентрата (при учете переработки отходов) 93-94% . Из отходов производства получают цинковый купорос, Pb, Cu, Cd, Au, Ag; иногда также In, Ga, Ge, Tl.
Применение Цинка. Около половины производимого Цинк расходуется на защиту стали от коррозии (Цинкование). Поскольку Цинк в ряду напряжений стоит до железа, то при попадании оцинкованного железа в коррозионную среду разрушению подвергается Цинк. Благодаря хорошим литейным качествам и низкой температуре плавления из Цинк отливают под давлением различные мелкие детали самолетов и других машин. Сплавы меди с Цинком — латунь, нейзильбер, а также Цинка со свинцом и других металлами широко применяются в технике. Цинк дает с золотом и серебром интерметаллиды (нерастворимые в жидком свинце) и поэтому Цинк применяется для рафинирования свинца от благородных металлов. В виде порошка Цинк служит восстановителем в ряде химико-технологических процессов: в производстве гидросульфита, при осаждении золота из промышленного цианистых растворов, меди и кадмия при очистке растворов цинкового купороса и других. Многие соединения Цинка являются люминофорами, например, три основных цвета на экране кинескопа зависят от ZnS·Ag (синий цвет), ZnSe·Ag (зеленый цвет) и Zn3(PO4)2·Mn (красный цвет). Важными полупроводниковыми материалами служат соединения Цинка типа A II B VI — ZnS, ZnSe, ZnTe, ZnO. Наиболее распространенные химические источники тока имеют в качестве отрицательного электрода Цинк.
Цинк в организме. Цинк как один из биогенных элементов постоянно присутствует в тканях растений и животных. Среднее содержание Цинка в большинстве наземных и морских организмов — тысячные доли процента. Богаты Цинком грибы, особенно ядовитые, лишайники, хвойные растения и некоторые беспозвоночные морские животные, например, устрицы (0,4% сухой массы). В зонах повышенных содержаний Цинка в горных породах встречаются концентрирующие Цинк так называемых галмейные растения. В организм растений Цинк поступает из почвы и воды, животных — с пищей. Суточная потребность человека в Цинке (5-20 мг) покрывается за счет хлебопродуктов, мяса, молока, овощей; у грудных детей потребность в Цинке (4-6 мг) удовлетворяется за счет грудного молока.
Биологическая роль Цинк связана с его участием в ферментативных реакциях, протекающих в клетках. Он входит в состав важнейших ферментов: карбоангидразы, различных дегидрогеназ, фосфатаз, связанных с дыханием и другими физиологическими процессами, протеиназ и пептидаз, участвующих в белковом обмене, ферментов нуклеинового обмена (РНК- и ДНК-по-лимераз) и других. Цинк играет существенную роль в синтезе молекул информационной РНК на соответствующих участках ДНК (транскрипция), в стабилизации рибосом и биополимеров (РНК, ДНК, некоторые белки).
В растениях наряду с участием в дыхании, белковом и нуклеиновом обменах Цинк регулирует рост, влияет на образование аминокислоты триптофана, повышает содержание гиббереллинов. Цинк стабилизирует макромолекулы различных биологических мембран и может быть их интегральной частью, влияет на транспорт ионов, участвует в надмолекулярной организации клеточных органелл. В присутствии Цинка в культуре Ustilago sphaerogena формируется большее число митохондрий, при недостатке Цинка у Euglena gracilis исчезают рибосомы. Цинк необходим для развития яйцеклетки и зародыша (в его отсутствии не образуются семена). Он повышает засухо-, жаро- и холодостойкость растений. Недостаток Цинка ведет к нарушению деления клеток, различным функциональным болезням — побелению верхушек кукурузы, розеточности растений и других. У животных, помимо участия в дыхании и нуклеиновом обмене, Цинк повышает деятельность половых желез, влияет на формирование скелета плода. Показано, что недостаток Цинка у грудных крыс уменьшает содержание РНК и синтез белка в мозге, замедляет развитие мозга. Из слюны околоушной железы человека выделен цинксодержащий белок; предполагается, что он стимулирует регенерацию клеток вкусовых луковиц языка и поддерживает их вкусовую функцию. Цинк играет защитную роль в организме при загрязнении среды кадмием.
Дефицит Цинк в организме ведет к карликовости, задержке полового развития; при его избыточном поступлении в организм возможны (по экспериментальным данным) канцерогенное влияние и токсическое действие на сердце, кровь, гонады и др. Производственные вредности могут быть связаны с неблагоприятным воздействием на организм как металлического Цинка, так и его соединений. При плавке цинкосодержащих сплавов возможны случаи литейной лихорадки. Препараты Цинка в виде растворов (сульфат Цинка) и в составе присыпок, паст, мазей, свечей (окись Цинка) применяют в медицине как вяжущие и дезинфицирующие средства.
Цинк: характеристика, свойства, особенности металла
Главная страница » Цинк: характеристика, свойства, особенности металла

Нержавеющие кровельные покрытия, вполне эффективная борьба с простудой, технология хранения электричества внутри аккумуляторной батареи и ещё ряд применений. Всё это цинк – химический элемент, конечно же, далёкий от ценностей платины или золота, не такой эффектный как серебро или медь, тем не менее, вполне привлекательный и популярный. Металл голубовато-белого цвета занимает 24 место по распространённости среди 92 элементов земной коры. Однако для добычи 65 граммов металла потребуется обработать не менее одной тонны породы в зоне залежей этого химического элемента.
Природное образование и конечное формирование
Аналогично многим другим металлам, цинк в природе не встречается в чистом виде. Как правило, этот химический элемент присутствует в минералах, сочетаясь с другими элементами, и присутствует как:
- оксид,
- силикат,
- карбонат.
Можно сказать, это традиционная цинковая составляющая. Поэтому, чтобы воспроизвести чистый металл, придётся прибегнуть к переработке сырья цинксодержащего минерала, процедуре, которая предполагает многоступенчатый процесс очистки (включающий несколько отдельных физических и химических этапов).
 Природный минерал, содержащий высокий процент химического вещества, широко используемого для самых разных целей. Структура минерала напоминает кварцевые образования характерными вкраплениями-блёстками
Природный минерал, содержащий высокий процент химического вещества, широко используемого для самых разных целей. Структура минерала напоминает кварцевые образования характерными вкраплениями-блёстками
Например, для переработки сульфида цинка необходимо измельчить сырьё в порошок, и тщательно промыть, чтобы избавиться от сульфидов других металлов, присутствующих в виде примесей. В конечном итоге получается оксид цинка (ZnO). Выщелачиванием (реакция с серной кислотой) получают раствор сульфата.
Затем используется электролиз (электрохимический процесс) для отделения чистого химического элемента. Также допустимо воспроизводить металл из минерального сырья путём плавки (нагревания углеродом), что традиционно и применяется в промышленном секторе.
Свойства, особенности, характеристики цинка
Если визуально исследовать кусок цинка, внешне металл, скорее всего, будет выглядеть серовато-белым по окрасу. Однако таким выглядит именно оксид, который образуется в результате реакции чистого металла с кислородом и углекислым газом в условиях влажной среды. Внешний вид чистого цинка несколько иной:
- блестящий,
- голубоватый,
- белесоватый,
- серебристый.
Этот металл не похож на железо и, прежде всего, по причине выраженной хрупкости. Однако стоит лишь нагреть металл до температуры 100–150°C, после чего структура приобретает свойства гибкости и легко обрабатывается.
Благодаря нагреву, материал допустимо превращать в различные формы и даже сворачивать в тонкие листы. Как и другие металлы, цинк представлен кристаллически-твёрдым веществом. Атомы цинка объединяются в гексагональные, плотно упакованные кристаллы.
 Процесс гальванизации – используется достаточно широко в народном хозяйстве для обработки самых различных металлических конструкций с целью защиты последних от негативного влияния окружающей среды
Процесс гальванизации – используется достаточно широко в народном хозяйстве для обработки самых различных металлических конструкций с целью защиты последних от негативного влияния окружающей среды
Большая часть добываемого химического элемента используется для гальванизации. Процесс гальванизация основан на электролизе, который включает в себя покрытие железа (стали) тонким защитным слоем цинка.
Под влиянием окружающего воздуха (кислорода и углекислого газа) чистое покрытие окисляется с последующим формированием карбоната цинка. Таким способом предотвращается фактор ржавления (коррозии) металлов в условиях влажной среды.
Изготовление и применение чистого металла
Многие виды повседневных хозяйственных вещей оцинкованы. Например:
- металлические крыши сооружений,
- водосточные желоба зданий,
- резервуары для воды и т.д.
Достаточно большая доля цинка используется в конструкциях одноразовых цинк-углеродистых не перезаряжаемых аккумуляторов. Процесс изготовления латуни также требует значительных объёмов этого вещества.
Характерной особенностью цинка является образование целого ряда полезных соединений:
- Сульфид (люминофор экранов старых телевизоров, осциллографов, люминесцентные лампы и светящиеся краски);
- Сульфат (защитные средства от сорняков, применение в текстильном производстве);
- Оксид (используется для изготовления резины, способствует улучшению свойств пластмасс, красок, чернила, бетона, косметики).
Многие известные сплавы формируются на цинковой составляющей. Например, латунь, зубная амальгама, бронза и некоторые виды припоев. Оцинковка не только предотвращает ржавление резервуаров для воды. Практически все виды лекарств от кашля и простуды, витаминные таблетки и добавки никак не обходятся без этого вещества.
 Часто встречающиеся таблетки (капсулы) биологических добавок включают добавки кальция для укрепления зубов и костей, витамин «С», омега-3 для глаз, а также цинк для усиления иммунитета
Часто встречающиеся таблетки (капсулы) биологических добавок включают добавки кальция для укрепления зубов и костей, витамин «С», омега-3 для глаз, а также цинк для усиления иммунитета
Дефицит цинка в организме сопровождается различными проблемами по отношению к здоровью организма, приводит к развитию болезней. Правда, в основном эта проблема характерна для развивающихся стран, где отмечаются факторы недоедания населения, недостаток сбалансированного полезного питания.
Цинк — история появления и статус элемента
Точно неизвестно — кому, где и когда удалось впервые обнаружить цинк. Однако археологами обнаруживались цинковые сплавы в местах, относящихся к доисторическим временам. Достоверно известно – древние римляне производили медные монеты, состав которых включал это вещество, правда, с примесями.
Минуло почти тысяча лет, прежде чем люди начали использовать цинк в качестве металла как такового. Историки предполагают — впервые производство металла отметилось в Индии XIII века. Ещё спустя 300 лет, на территории Китая началось производство цинка в крупных масштабах.
Современная история начала производства цинка исчисляется от середины XVIII века. Первым 1737 году разработал и запатентовал процесс производства чистого цинка английский металлург Уильям Чампион. Производство в огромных промышленных масштабах осуществлялось путём плавки каламина древесным углем.
Между тем вещество окончательно было признано химическим элементом в 1746 году, благодаря усилиям немецкого химика по имени Андреас Сигизмунд Маргграф. Немецкий учёный использовал методы, подобные тем, что использовал Чемпион, с целью детального изучения цинка в стенах лаборатории.
Цинк и его характеристики
Общая характеристика цинка
Главные природные соединения цинка, из которых его добывают, — минералы галмей ZnCO3 и цинковая обманка ZnS. Общее содержание цинка в земной коре составляет приблизительно 0,01% (масс.).
Цинк – голубовато-серебристый металл (рис. 1). При комнатной температуре он довольно хрупок, но при 100-150 o С он хорошо гнется и прокатывается в листы. При нагревании выше 200 o С цинк становится очень хрупким. На воздухе он покрывается тонким слоем оксида или основного карбоната, предохраняющим его от дальнейшего окисления. Вода почти не действует на цинк.

Рис. 1. Цинк. Внешний вид.
Атомная и молекулярная масса цинка
Относительной молекулярная масса вещества (Mr) – это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (Ar) — во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.
Поскольку в свободном состоянии цинк существует в виде одноатомных молекул Zn, значения его атомной и молекулярной масс совпадают. Они равны 65,38.
Изотопы цинка
Известно, что в природе хром может находиться в виде пяти стабильных изотопов 64 Zn, 66 Zn, 67 Zn, 68 Zn и 70 Zn. Их массовые числа равны 64, 66, 67, 68 и 70 соответственно. Ядро атома изотопа цинка 64 Zn содержит тридцать протонов и тридцать четыре нейтрона, а остальные изотопы отличаются от него только числом нейтронов.
Существуют искусственные нестабильные изотопы цинка с массовыми числами от 54-х до 83-х, а также десять изомерных состояний ядер, среди которых наиболее долгоживущим изотопом является 65 Zn с периодом полураспада равным 243,66 суток.
Ионы цинка
На внешнем энергетическом уровне атома цинка имеется два электрона, которые являются валентными:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 .
В результате химического взаимодействия цинк отдает свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион:
Молекула и атом цинка
В свободном состоянии цинк существует в виде одноатомных молекул Zn. Приведем некоторые свойства, характеризующие атом и молекулу цинка:
Энергия ионизации атома, эВ
Радиус атома, нм
Сплавы цинка
Широкое промышленное значение имеют сплавы цинка с алюминием, медью и магнием. С медью цинк образует важную группу сплавов – латуни. Латуни содержат до 45% цинка. Различают простые и специальные латуни. В состав последних входят другие элементы, например железо, алюминий, олово, кремний.
Примеры решения задач
| Задание | Технический цинк массой 0,33 г обработали разбавленным раствором серной кислоты. Выделившийся водород занимает при нормальных условиях объем 112 мл. Рассчитайте массовую долю цинка в техническом металле. |
| Решение | Запишем уравнение реакции взаимодействия цинка с разбавленной серной кислотой: |
Найдем количество моль выделившегося в ходе реакции водорода:
n (H2) = 112×10 -3 / 22,4 = 0,005 моль.
Согласно уравнению реакции n (H2):n (Zn) = 1:1, т.е. n (H2) = n (Zn) =0,005 моль. Тогда, масса чистого цинка (без примесей) будет равна (молярная масса – 65 г/моль):
mpure (Zn) = n (Zn) × M (Zn);
mpure (Zn)= 0,005 × 65 = 0,325 г.
Массовая доля цинка в техническом металле рассчитывается как:
ω(Zn) = 0,325/ 0,33 × 100%;
| Задание | Рассчитайте массу цинка, который нужно растворить в соляной кислоте, чтобы получить водород, необходимый для восстановления оксида меди (II) массой 20 г до металла. |
| Решение | Запишем уравнения реакций, которые протекают согласно условию задачи: |
Рассчитаем количество вещества оксида меди (II) (молярная масса – 80 г/моль):
n (CuO) = m (CuO) / M (CuO);
n (CuO) = 20 / 80 = 0,25 моль.
Согласно уравнению (2) n (CuO):n (H2) = 1:1, т.е. n (CuO) = n (H2) =0,25 моль. Тогда, число моль цинка вступившего в реакцию взаимодействия с соляной кислотой будет равно 0,25 моль, поскольку n (Zn):n (H2) = 1:1, т.е. n (Zn) = n (H2).
Масса цинка (молярная масса равна 65 г/моль) равна:
mpure (Zn) = n (Zn) × M (Zn);
mpure (Zn)= 0,25 × 65 = 16,25 г.
Цинк — металл с широким применением и важным биологическим значением
![]()
При стандартных условиях цинк представляет собой хрупкий металл. Имеет бело-голубоватый цвет.
- История металла
- Откуда возникло название «цинк»
- Цинк в природе
- Крупнейшие мировые цинковые месторождения
- Специфика получения металла
- Физические признаки
- Химические признаки
- Применение
- Производство в мире, запасы и способы добычи
- Значение для организма
- Цинк и его концентрация в продуктах
- Нехватка цинка в организме и ее проявления
- Токсичность металла
- Динамика цен на цинк, прогноз на 2018 год
История металла
Длительное время цинк не удавалось получить в чистом виде. Впервые это было сделано в 1738 году. Автором открытия стал Уильям Чемпион. Тогда же металлург запатентовал его дистилляционный вариант получения.
Спустя 5 лет в 1743 году тем же металлургом был открыт первый завод. В 1746 году химик А.С. Маргграф разработал схожий вариант получения чистого цинка. В 1805 году в английском Шеффилде была запатентована прокатка в качестве метода обработки металла. Она производилась при 150 0 С.
В России цинк был произведен на металлургическом заводе «Алагир». Событие датируется началом 1905 года. Электролитический метод получения металла стал применяться в 1915 году на американских и канадских заводах.
Откуда возникло название «цинк»
Слово «цинк» стало фигурировать в различных источниках с первой половины XVI века. Название «zincum», а также «zinken» упоминается в трудах швейцарского алхимика Парацельса. В немецком языке термин «zinke» означает «зубец». Кристаллиты металла внешне напоминают иглы.
Цинк в природе
Существует порядка 66 видов цинка. Сфалерит встречается чаще прочих. Его также именуют цинковой обманкой. Металл в большей степени присутствует в изверженных породах.
Молярная масса цинка составляет 65,38 г/моль. Отмечается миграция элемента как в подземных, так и поверхностных водах. Хорошим осадителем для цинка выступает сероводород. Металл является важным компонентом живых организмов.
Крупнейшие мировые цинковые месторождения
Добыча цинка в связи с обширными месторождениями металла развита в Китае, Австралии, Перу, США. Значительные месторождения также имеются в Казахстане. Крупными игроками на бирже цинка выступают Индия, Канада, Мексика.
Специфика получения металла
Гидрометаллургический метод служит базовым вариантом получения металла. Сначала концентраты обжигаются. В дальнейшем происходит их обработка серной кислотой. В итоге получается сульфатный раствор. Производится его очистка от примесей. Затем проводится электролиз в специальных свинцовых ваннах.
В результате электролиза происходит осаждение цинка на катодах из алюминия. Чистый металл каждый день удаляют с них, после чего он плавится в индукционных печах.
Интересный факт! В самородном виде цинк в природе нигде не наблюдается.
Физические признаки
Свойства металла цинка включают в себя следующие характеристики:
- средняя пластичность;
- бело-серебристый цвет;
- хрупкость.
Физические свойства цинка таковы, что его пластичность при температуре 100 0 С становится высокой. Хрупкость элемента увеличивается при наличии даже небольшого количества примесей.
Химические признаки
Отмечаются следующие свойства цинка:
- образование амфотерных соединений;
- активное реагирование с растворами кислот и щелочными средами;
- отсутствие непосредственного реагирования с водородом, а также углеродом;
- образование ионами металла аквакомплексов в водных растворах.
Характерны также химические свойства цинка в виде показателя электроотрицательности, равной 1,65. Электродный потенциал у металла составляет -0,76 В.
Применение
Металл используется следующим образом:
- для защиты стали от процесса коррозии;
- в качестве компонента цинк-воздушных аккумуляторов;
- в полиграфии;
- в качестве компонента твердых припоев для уменьшения их температуры плавления;
- для изготовления краски;
- в качестве антисептика и средства против воспаления;
- при изготовлении латуни;
- при производстве люминофоров;
- для производства оптических стекол.
Производство в мире, запасы и способы добычи
В мире производится порядка 10 миллионов тонн. Химический элемент цинк преимущественно добывается в Китае. На эту страну приходится 29% или 3,5 миллиона тонн. В тройку лидеров по запасам цинка входят Перу и Австралия. В топ-5 списка также входят Индия и США.
В России запасы цинка составляют 190 тысяч тонн. Это 11-е место среди всех стран-лидеров по добыче цинка.
Интересный факт! Цинк занимает четвертую позицию по применению среди всех известных металлов. На первом месте идет железо, на втором — алюминий, на третьем — медь.
Элемент преимущественно добывается открытым способом. Для этого при помощи тяжелой техники формируется карьер. Сегодня это самый доступный вариант добычи металла. Гораздо реже используется закрытый тип добычи. Создание подземных карьеров считается нерентабельным мероприятием.
Значение для организма
Элемент в количестве 2 г преимущественно содержится в печени, мышцах и поджелудочной железе. Отмечается наличие цинка в составе свыше 400 ферментов.
Элемент играет следующую роль:
- участвует в продуцировании спермы и гормонов у мужчин;
- принимает участие в превращении витамина Е;
- нормализует работу простаты;
- принимает участие в синтезировании тестостерона и инсулина;
- участвует в расщеплении алкоголя.
Цинк и его концентрация в продуктах
Продуктами-лидерами по содержании данного элемента являются устрицы, семечки тыквы и подсолнуха, кунжут, сыр, бобовые, мясо и шоколад. Отмечается присутствие металла в минеральной воде.
Интересный факт! В 100 г устриц может содержаться до 40 мг цинка. Это самый богатый данным микроэлементом продукт питания. На втором месте по его содержанию идут тыквенные семечки (10 мг).
Нехватка цинка в организме и ее проявления
С учетом характеристики цинка недостаток данного элемента может провоцировать у человека:
- утомление;
- нарушение памяти;
- раздражительность;
- депрессии;
- ухудшение зрения;
- снижение веса;
- понижение уровня инсулина;
- аллергические реакции;
- анемию.
Токсичность металла
С учетом формулы цинка элемент может быть токсичным для человека. Опасность представляют сульфаты цинка, провоцирующие нарушение роста, малокровие и даже бесплодие. Отравление оксидом цинка провоцирует потерю аппетита, жажду и сладкий привкус во рту. В дальнейшем человек становится сонливым, начинает чувствовать боли в груди. У него возникает сухой кашель.
Динамика цен на цинк, прогноз на 2018 год
С начала года прослеживается общая отрицательная динамика цен на цинк. Если в феврале 2018 года за тонну металла давали 3577,25 долларов, то по состоянию на 18 мая Лондонская Биржа Металлов (LME) установила курс цинка, равный 3096,50 долларов.
В 2016 году цинк имел статус самого доходного и подходящего для инвестиций металла. В 2017 году отметилась тенденция к снижению инвестиционной привлекательности данного элемента. При этом большинство аналитиков полагают, что цинк в 2018 останется лидером среди цветных металлов.
Deutsche Bank дает прогноз по цинку, в котором предполагается рост цены на металл на 8%. В ближайшие месяцы прогнозируется стоимость тонны металла в пределах 3120-3160 долларов.
Цинк: характеристика, свойства, особенности металла

Zn (Zincum)
Цинк представляет собой металл светло-голубого цвета, который может принять тусклый оттенок на воздухе. В таблице Менделеева он входит во вторую группу четвёртого периода периодической системы.
История появления цинка
В древние времена цинк не был известен. Были известны такие металлы как железо, латунь. Выделить цинк из латуни в течении многих веков не удавалось. В середине 18 века в Англии ряд ученых смогли получить металл дистилляционным образом. Через несколько лет был создан новый способ получения цинка. Он заключался в горячем плавлении с дальнейшим охлаждением в холодильных камерах. Данный способ стал основой для дальнейшего получения цинка. Ученые детально раскрыли тонкости его получения и считаются первыми открывателями данного метала.
В 19 веке ряд других ученых смогли получить цинк новым способом. Данный метод заключался в температурной обработке. В нашей стране цинк был получен в 20 веке. Через несколько лет американцы запатентовали новый способ получения металла. Это был электролитический метод.

Происхождение названия «цинк»
С немецкого языка цинк обозначает кристаллы, напоминающие иглы. Впервые о данном металле было рассказано в работах Парацельса. Известно более 60 минералов цинка. Среди них можно отметить цинкит, виллемит, смитсонит. Самый часто встречающийся минерал — это сфалерит. Иногда его именуют цинковая обманка. В основе данного минерала лежит сульфид цинка. С помощью различных примесей можно получить всевозможные оттенки. Однако данный минерал весьма сложно определить. Отсюда и берет сфалерит свое второе название: цинковая обманка.
Цинковая обманка является основой для других минералов цинка. Среди них можно выделить цинкит, каламин и многие другие. В алтайских рудниках не редко можно встретить смесь цинковой обманки и бурого шпата. Такую смесь называют бурундучная руда. Если посмотреть на нее издалека, то можно заметить схожесть с известным зверем.
Сфалерит
В земле находится порядка от 8 до 10 % цинка. В некоторых вулканических породах можно найти большое содержание цинка. Считается, что цинк приходит с подземными водами, из которых осаждаются сульфиды цинка. Данные сульфиды находят свое широкое применение в промышленности. Вместе с этим цинк можно встретить в морской воде, озерах и реках. В организме человека и животных так же имеется цинк. Он может составлять до 4 % от общей массы. В определённых организмах наблюдается повышенное содержание данного металла.
Где можно встретить цинк
Цинк в можно встретить в Австралии, на территории Казахстана, и Ирана. В нашей стране он производится на предприятии Дальполиметалл.
Получение цинка
В природе чистого цинка не существует. Он содержится, как правило, в различных рудах. Что бы получить чистый цинк нужно проводить ряд химических, термических процессов. Так же посредством химических процессов получаются различные концентраты цинка. Они используются при производстве серной кислоты.
Оксид цинка получается несколькими вариантами. Обожжённый концентрат спекают. Получается зернистый и газопроницаемый состав. Далее его обрабатывают посредством угля, кокса при высокой температуре. Пары метала, выпадающие в конденсат, размещают в специальные формы. Существует несколько способов восстановления металла. Среди них необходимо выделить роторный способ, заключающийся в ручном обслуживании. Позднее появились механизированные системы и дуговые электропечи. Получение цинка из свинца производится в шахтных печах. Со временем технологии получения цинка усовершенствовались, однако оставался большой процент примеси при получении металла. Одним из самых распространенных способов очищения метала было его отстаивание от примесей под высокой температурой. Это позволяло получить металл с чистотой до 98 %. Наиболее дорогая и трудная очистка позволяет получить металл с чистотой до 99,9%. В частности, из цинка удаляются такие элементы как свинец, железо. Такой процесс позволяет получить более чистый металл. Однако в нем по-прежнему содержалось несколько процентов примесей. Среди главных элементов примесей можно выделить кадмий.
При высокой температуре с помощью способа отстаивания можно получить цинк с чистотой до 98 %. Данный способ называется дистилляционная очистка. В частности, цинк очищается от свинца. Более сложный процесс очистки цинка от посторонних элементов позволяет получить метал с чистотой до 99 %. Из цинка удаляется кадмий. Очистить металл от примесей можно с помощью серной кислоты. Обожжённые концентраты вступают в реакцию с металлом и удаляют различные примеси. Раствор в дальнейшем необходимо подвергнуть электролизу. В результате данного процесса на катодах оседает цинк. После оседания он снимается под высокой температурой в специальных печах. Такой способ позволяет получить металл с чистотой до 99%.
Отходы, полученные в процессе очищения, используют для создания цинкового купороса.
Физические свойства цинка
Цинк — это металл светлого цвета с серебристым оттенком. При обычной комнатной температуре он весьма хрупок. Если начать сгибать металл, то можно услышать небольшой треск. Это растрескиваются кристаллы от трения. При температуре более 100 градусов металл становится пластичным. Если в цинке имеются примеси, хрупкость металла значительно повышается.
Химические свойства
Цинк считается элементом, способным образовывать амфотерные соединения. В атмосфере цинк оксидируется и образует пленку. Цинк не вступает в реакцию щелочами и кислотами. Реакция происходит только при добавлении небольшого объема сульфата меди. При температуре цинк вступает в реакцию с галогенами и способствует образованию галогенидов. При добавлении в цинк фосфора образуются фосфиды. Взаимодействие с серой или ее аналогами образует халькогениды. С такими веществами как азот, бор цинк не вступает в реакцию. Нитрид цинка получается посредством реакции цинка и аммиака при температуре от 500 до 600 градусов.
Использование цинка
Данный металл находит свое применение для получения некоторых металлов в чистом виде. В первую очередь речь идет о золоте. Как правило, благородные металлы очищаются посредством цинка, если они добыты подземным способом. Вместе с этим цинк применяется для получения благородных металлов из свинца. Полученный метал часто называют серебристая пена, которая впоследствии обрабатывается аффинажными способами.
Помимо этого, цинк активно применяется в качестве антикоррозийного элемента для стали и других металлов. При этом металл не должен иметь механических повреждений. Это относится к автомобилестроению и кораблестроению. Так же цинк используется для строительства мостов, бытовых предметов и различных конструкций.
Цинк является важным элементов при создании аккумуляторов и батареек. Химические источники тока являются популярным решением получения энергии как для мелких потребностей, таки крупных объектов. Соединения цинка с марганцем, ртутью, медью, хромом, хлором и другими химическими элементами позволяют получить эффективный источник тока.
При создании воздушных аккумуляторов цинк играет важнейшую роль. Благодаря данному металлу, получается создать аккумулятор с большой энергоемкостью. Такие аккумуляторы применяются для запуска двигателей. Вместе с этим в электромобилях аккумуляторы, созданные с применением цинка, обеспечивают транспортному средству пробег более 900 километров без подзарядки.
При создании полиграфической продукции цинк становится незаменимым элементом. В частности, для создания матриц печати многотиражной продукции. Уже более двух веков применяется способ цинкографии. Он заключается в изготовлении штампа на основе пластины из цинка и вытравливания на ней изображения. Хорошее изображение, рисунок получается при добавлении свинца. Остальные примеси могут ухудшить качество продукции. Перед изготовлением цинковую матрицу отжигают при заданной температурой и придают необходимую форму. Цинк так же применяется для создания определённых припоев. Припои с цинком позволяют уменьшить температуру плавления.
Помимо этого, цинк активно применяется в медицинских целях. Его окись является отличным противовоспалительным средством и хорошим антисептиком. Мази с цинком являются незаменимым средством для заживления ран. Врачи рекомендуют чаще употреблять продукты с содержанием металла. Цинк активно влияет на улучшение работы половой, нервной и пищеварительной системы. При производстве гормонов, ферментов цинк является важнейшим незаменимым элементом. Пониженное содержание цинка может вызвать ухудшение работы организма. Очень много цинка находится в морских продуктах.
При производстве краски окись цинка становится основой для создания белил.
В латуни цинк это один из главных компонентов. А сплавы с алюминием дают цинку высокие механические качества. Такие сплавы используются в промышленности. Точное литье позволяет применять сплав цинка при производстве деталей оружия. К примеру, затворов травматических пистолетов. Вместе с этим из сплава цинка изготавливают фурнитуру для мебели, деталей автомобилей и другие изделия. С помощью сульфида цинка создаются люминофоры. Помимо этого, сульфиды применяются для создания гибких экранов.
Теллурид цинка является важным элементом для создания полупроводников. Фосфид цинка является основой для создания отравы для мелких вредителей.
Покрышки для автомобилей, имеющие в своём составе окись цинка, имеют высокое качество и прочные характеристики.
При производстве оптических стекол применяется селенид цинка.
В состав многих красок входит цинк. Окись цинка используется для создания белой краски. Она находит сове активное применение при производстве космических аппаратов. Краска с добавлением цинка хорошо отражает цвет. Такой отражатель можно получить только с помощью цинка.
Для обнаружения радиации цинк стал незаменимым элементом. Лучи радиации вспыхивают в присутствии сульфида цинка.
В быту нередко можно встретить предметы и изделия, имеющие в своём составе цинк. Например ведра, ванны, посуда, кровельные листы. Такие изделия обеспечивают продолжительный срок эксплуатации, а также имеют низкую стоимость по сравнению с изделиями из другого материала. Количество оцинкованных изделий растет каждый год.
Для изделий из металла, которые в дальнейшем будут использоваться в агрессивной среде цинковое покрытие стало единственно возможно защитным способом. Речь идет о металлических изделиях, которые эксплуатируются в озерах, реках, а также в атмосфере. Морские платформы, трубопроводы и другие подводные и надводные конструкции имеют цинковое покрытие. Его отсутствие приводит к преждевременному выходу оборудования и конструкции из строя, и соответственно требует постоянного ремонта и финансовых затрат. Сварные швы становятся защищенными от воздействия атмосферы, если на них наносится цинковое опыление.
Мировое производство цинка
Цинк считается одним из самых часто используемых металлов. Перед ним стоят железо, алюминий и другие металлы. Только за 2009 год в мире получено более 11 тысяч миллионов тонн. Однако в настоящее время наблюдается снижение производства данного металла. Больше всего цинка, согласно представленной информации, производится в Соединенных Штатах Америки.
Вредность цинка для организма
При попадании в организм солей цинка, а также сульфатов может произойти серьезное отравление организма. Достаточно одного грамма, что бы у человека началась рвота и головные боли. В обычной жизни длительное хранение пищевых продуктов в оцинкованной посуде может так же вызвать большие проблемы в организме. Отравления могут оказать негативное воздействие на дальнейшее развитие организма, а также вызвать бесплодие у женщин, образовать малокровие, задержать рост и многое другое.
Оксид цинка попадает в организм посредством вдыхания паров. Во рту может появиться сладкий привкус. Вместе с этим человек теряет аппетит, ощущается жажда. Наблюдается повышенная утомляемость, постоянная боль в груди, вялость, кашель и общее ухудшение самочувствия.
Но необходимо помнить, что цинк имеется в любом организме. Он нужен для правильного и полноценного развития клеток. Для борьбы со старением цинк один из немногих элементов, который оказывает активное омолаживающее действие. Поэтому недостаток цинка приводит к ряду заболеваний, среди которых можно отметить диабет, половые проблемы и многое другое.
Температура плавления цинка, свойства и применение металла
 Цинк — хрупкий металл белого цвета с голубым оттенком. На воздухе покрывается тонкой оксидной плёнкой. Латунь (медно-цинковый сплав) использовали ещё до нашей эры в Древней Греции и Древнем Египте. На сегодняшний день цинк — один из самых важных для многих отраслей человеческой деятельности. Он незаменим в промышленности, медицине. Важен для нормального функционирования человеческого организма
Цинк — хрупкий металл белого цвета с голубым оттенком. На воздухе покрывается тонкой оксидной плёнкой. Латунь (медно-цинковый сплав) использовали ещё до нашей эры в Древней Греции и Древнем Египте. На сегодняшний день цинк — один из самых важных для многих отраслей человеческой деятельности. Он незаменим в промышленности, медицине. Важен для нормального функционирования человеческого организма
- Химические и физические свойства и история металла
- Месторождения и получение
- Свойства металла и использование в производстве
- Содержание в организме человека и продуктах питания
Химические и физические свойства и история металла
Несмотря на использование с давних времён в различных целях, чистый цинк получить никак не удавалось. Только в начале восемнадцатого века Уильям Чемпион сумел открыть способ выделения этот элемент из руды с помощью дистилляции. В 1838 году он запатентовал своё открытие, а спустя 5 лет, в 1843 году, Уильямом Чемпионом был запущен первый в истории завод по выплавке этого металла. Спустя некоторое время Андреас Сигизмунд Маргграф открыл ещё один метод. Этот способ был признан более совершенным. Поэтому именно Маргграфа зачастую считают открывателем чистого цинка. Последующие открытия только поспособствовали расширению его популярности.
Месторождения и получение
 Самородного цинка в природе не существует. Сегодня используется около 70 минералов, из которых его выплавляют. Самый известный — сфалерит (цинковая обманка), который содержится в незначительных количествах в организме человека и животных, а также в некоторых растениях. Больше всего — в фиалке.
Самородного цинка в природе не существует. Сегодня используется около 70 минералов, из которых его выплавляют. Самый известный — сфалерит (цинковая обманка), который содержится в незначительных количествах в организме человека и животных, а также в некоторых растениях. Больше всего — в фиалке.
Цинковые минералы добывают в Казахстане, Боливии, Австралии, Иране, России. Лидеры по производству — Китай, Австралия, Перу, США, Канада, Мексика, Ирландия, Индия.
На сегодняшний день самый популярный метод получения чистого металла — электролитический. Чистота получаемого металла почти стопроцентная (возможны лишь небольшие примеси в объёме не более нескольких сотых процента. В целом они незначительны, поэтому такой цинк считается чистым).
Общее производство цинка во всём мире оценивается примерно в более чем десять миллионов тонн в год.
Свойства металла и использование в производстве
Цвет чистого металла — серебристо-белый. Довольно хрупок при температуре двадцать-двадцать пять градусов (т.е. комнатной), особенно если содержит примеси. При нагревании до 100 — 150 градусов по Цельсию металл становится пластичным и ковким. При разогревании выше чем сто-сто пятьдесят градусов хрупкость опять возвращается.
- Температура плавления цинка — 907 градусов по Цельсию.
- Относительная атомная масса цинка — 65,38 а. е. м. ± 0,002 а. е. м.
- Плотность цинка — 7,14 г/см 3 .
Металл цинк занимает четвертое место по использованию в различных сферах производства:
 Он применяется при добыче и обработке золотой и серебряной руды.
Он применяется при добыче и обработке золотой и серебряной руды.- Оцинковка защищает сталь от коррозии.
- Важную роль металл играет в батарейках и аккумуляторах.
- С помощью цинковых пластинок печатаются иллюстрации в журналах и книгах.
- В медицине цинковая окись используется как антисептик.
- Применяется в автомопроизводстве.
Содержание в организме человека и продуктах питания
Организм человека обычно содержит около двух граммов цинка. Многие ферменты содержат в себе этот металл. Элемент играет роль в синтезе важных гормонов, таких как тестостерон и инсулин. Элемент крайне необходим для полноценного функционирования мужских половых органов. Кстати, он даже помогает нам справиться с сильным похмельем. С его помощью выводится из нашего организма лишний алкоголь.
Недостаток цинка в рационе может привести к множеству нарушений функций организма. Такие люди подвержены депрессии, постоянной усталости, нервозности. Дневная норма для взрослого мужчины — 11 миллиграммов в день, для женщины — 8 миллиграмм.
Содержание в продуктах (в миллиграммах на 100 грамм продукта):
 устрицы — 40 мг;
устрицы — 40 мг;- отруби — 16 мг;
- семена тыквы — 10 ;
- печень говяжья — 8 мг;
- говядина — 8 мг;
- баранина — 6 мг;
- семена подсолнуха — 5 мг;
- сыр — 4 мг;
- овёс — 4 мг;
- курица — 3 мг;
- орехи грецкие — 3 мг;
- фасоль — 3 мг;
- свинина — 3 мг;
- шоколад — 2 мг;
- кукуруза — 0,5 мг;
- бананы — 0,15 мг.
Избыток элемента в человеческом организме также приводит к серьёзным проблемам, поэтому не стоит хранить продукты в цинковой посуде.


 Он применяется при добыче и обработке золотой и серебряной руды.
Он применяется при добыче и обработке золотой и серебряной руды. устрицы — 40 мг;
устрицы — 40 мг;
:max_bytes(150000):strip_icc()/KaylaDube-d1b0fdb0e7704d5697568c25cda4350b-d6299b7e4de84ddea274b57b2124ba5e.jpeg)