Аргон — самый распространённый инертный газ в земной атмосфере
Почему некоторые газы называются «благородными»?
Даже если вы очень далеки от химии, скорее всего, вы хотя бы раз в своей жизни могли услышать выражение «благородные газы». К ним относятся всем известные неон, криптон, аргон, ксенон, гелий и радон. Так почему же именно газы стали называться благородными? И в чем же именно заключается их благородство? Давайте попробуем разобраться вместе.

Благородных газов в природе всего 6: Неон, Криптон, Аргон, Ксенон, Гелий и Радон
Что такое инертные газы?
Благородные газы, известные в химии благодаря своему уникальному свойству не смешиваться с другими веществами, также часто называют инертными. Как можно судить из названия, “благородство” инертных газов не позволяет им взаимодействовать с более простыми субстанциями и даже друг с другом. Такая избирательность благородных газов вызвана их атомным строением, которое проявляется в замкнутой внешней электронной оболочке, не позволяющей радону, гелию, ксенону, аргону, криптону и неону обмениваться своими электронами с атомами других газов.
Самым распространенным инертным газом в природе считают аргон, который занимает почетное третье место по содержанию в атмосфере Земли после азота и кислорода. У аргона нет вкуса, запаха и цвета, однако именно этот газ считается одним из самых распространенных во Вселенной. Так, наличие этого газа наблюдается даже в некоторых планетарных туманностях и в составе некоторых звезд.

При нагревании в газоразрядной трубке аргон приобретает розовый оттенок
Самым редким благородным газом в природе считают ксенон, который несмотря на свою редкость, содержится в атмосфере Земли наряду с аргоном. Ксенон обладает наркотическими свойствами и часто применяется в медицине в качестве анестезирующего средства. Кроме того, согласно данным Всемирного антидопингового агентства, ингаляции этого редкого газа имеют допинговый эффект, влияющий на физическое состояние применяющих его спортсменов. Заполнение ксеноном легких человека приводит к временному понижению тембра голоса, что является эффектом, обратным применению гелия.
При нагревании ксенон светится фиолетовым цветом
Четверо остальных благородных газов — Радон, Гелий, Неон и Криптон — также обладают своими уникальными свойствами. Все они не имеют какого-либо специфического вкуса, запаха или цвета, однако присутствуют в атмосфере Земли в небольших количествах и важны для нашего дыхания. Так, гелий считается одним из самых распространенных элементов в космосе, а его наличие в атмосфере Солнца, в составе других звезд Млечного Пути и некоторых метеоритов подтверждено научными данными.
Если вам нравится данная статья, приглашаю вас присоединиться к нашему каналу на Яндекс.Дзен, где вы сможете найти еще больше полезной информации из мира популярной науки и техники.
Неон, светящийся при нагревании красноватым оттенком, получается из воздуха при его глубоком охлаждении. Из-за сравнительно небольшой концентрации этого инертного газа в атмосфере планеты, неон чаще всего получают в качестве побочного продукта при добыче аргона.
Радон — радиоактивный инертный газ, который может представлять опасность для человеческого здоровья. Газообразный радон способен светиться голубым или синим светом, постепенно облучая человека и даже приводя к онкологическим заболеваниям. Несмотря на это, в медицине часто применяются так называемые радоновые ванны, которые позволяют добиться положительного эффекта при лечении болезней центральной нервной системы.

Радоновое озеро в селе Лопухинка Ленинградской области
И наконец, последний благородный газ, который можно найти в природе — криптон. Это один из самых редких благородных газов во Вселенной. В отличии от остальных инертных газов, этот газ при определенных условиях может испускать резкий запах, схожий с запахом хлороформа. Воздействие криптона на человека и животных крайне мало изучено из-за невероятной редкости этого газа.
Где применяются благородные газы?
Самыми применяемыми человеком инертными газами считаются аргон, гелий и неон, которые используются повсеместно от физики до медицины. Так, гелий используется при сварке металлов и в качестве хладоносителя при проведении лабораторных экспериментов. Неон и аргон часто применяются при изготовлении ламп накаливания и в металлургии, при изготовлении алюминиевых сплавов.

Благодаря своим уникальным свойствам, благородные газы нашли свое применение в разных отраслях науки
Остальные благородные газы чаще всего используются в медицине. Как уже упоминалось выше, радон находит свое применение в медицине, а ксенон и криптон используются в качестве наполнителя осветительных ламп.
Новости, статьи и анонсы публикаций
Свободное общение и обсуждение материалов




Вселенная — волшебное окно времени, позволяющее нам заглянуть в прошлое. Чем дальше мы смотрим, тем дальше назад во времени мы видим. В отличие от наших мозг…

Невидимость — как и путешествие во времени, телепортация, левитация и сверхскорость — является предметом обсуждения научной фантастики с самого ее появления….

Какие ассоциации вы испытываете, когда слышите слово «мираж»? Как правило, вам представляется усталый путник, который бредет по раскаленному песку и палящему…
Газ аргон: технические характеристики и применение

Инертные газы практически не вступают в реакцию с другими веществами, поэтому их нельзя использовать, например, для отопления жилища или производства химических соединений. Несмотря на свой «асоциальный характер» такие элементы получили очень большое распространение в промышленности, благодаря наличию очень интересных физических свойств. Газ аргон относится именно к таким элементам.
Об основных качествах аргона, а также о сферах его применения будет подробно рассказано в этой статье.
Аргон: технические характеристики
Аргон представляет собой бесцветный газ, который не оказывает никакого действия на органы вкуса и обоняния. Этот одноатомный элемент является одним из самых распространённых инертных газообразных веществ на земле.
Аргон был открыт в конце XIX века британским учёным Джоном Стреттом. Исследователь проводил опыты по выделению азота из воздуха. В результате экспериментов было выяснено, что азот полученный таким образом имеет немного большую плотность, чем в случае, когда для получения этого газа использовались органические вещества. Учёный предположил, что азот из атмосферы содержит примесь неизвестного на тот момент газообразного вещества. Впоследствии, эти догадки были подтверждены, и аргон был получен в чистом виде и тщательно исследован.
 Учёных, которые пытались произвести различные опыты с аргоном, ошеломил тот факт, что этот газ не вступал в реакцию с другими химическими элементами. Таким образом удалось впервые получить благородный газ с подобными характеристиками.
Учёных, которые пытались произвести различные опыты с аргоном, ошеломил тот факт, что этот газ не вступал в реакцию с другими химическими элементами. Таким образом удалось впервые получить благородный газ с подобными характеристиками.
Несмотря на отсутствие соединений аргон, как и другие вещества, обладает физическими свойствами. К наиболее важным характеристикам газа относятся:
- Плотность: 1,784 кг/м3.
- Температура кипения: -185,8 ˚С.
- Тройная точка: -189,8˚С.
- Содержание в воздухе: 0,9% объёма.
Аргон практически не растворяется в воде, а также абсолютно безопасен в плане пожарной активности. Этот газ не ядовит, поэтому при работе с ним не требуется использовать каких-либо средств защиты.
Где применяется аргон
Аргон получил большое распространение в промышленности. Инертные свойства этого газа особенно востребованы в различных производственных процессах, где необходимо вытеснить один из самых активных элементов – кислород. Использование аргона очень дёшево, в сравнении с другими инертными летучими веществами, поэтому газ незаменим в том случае, когда требуется защитная среда при сваривании металлов, а также вытеснение влаги и кислорода в ёмкостях, где хранятся пищевые продукты.
Наполнение колб ламп накаливания инертным газом, позволяет значительно увеличить ресурс работы осветительного прибора. Кроме повышенного срока использования такие элементы обладают большей яркостью. Используется инертный газ и при производстве люминесцентных ламп. Применение аргона позволяет облегчить запуск разряда электрической дуги, а также значительно увеличить ресурс электродов.
При изготовлении стеклопакетов, инертным газом заполняются полости между стёклами, что позволяет значительно улучшить теплоизоляционные свойства. Учитывая тот факт, что аргон является абсолютно прозрачным, использование его никак не ограниченно даже при изготовлении многослойных конструкций.
 Инертный газ аргон используется также в установках плазменной резки металлов. Преимущество использования этого газа заключается в том, что для возникновения дуги не требуется слишком высокого напряжения, поэтому такие установки могут иметь очень простую конструкцию. При генерации плазмы с использованием аргона образуется минимальное количество вредных газообразных веществ во время выполнения резки, поэтому этот метод идеально подходит для ручных приборов.
Инертный газ аргон используется также в установках плазменной резки металлов. Преимущество использования этого газа заключается в том, что для возникновения дуги не требуется слишком высокого напряжения, поэтому такие установки могут иметь очень простую конструкцию. При генерации плазмы с использованием аргона образуется минимальное количество вредных газообразных веществ во время выполнения резки, поэтому этот метод идеально подходит для ручных приборов.
Благодаря возможности образовывать плазму при относительно невысоком напряжении, этот благородный газ используется в медицине для проведения аргоновой коагуляции. Такой метод успешно используется для удаления новообразований, а также для остановки кровотечений.
Аргон применяется и в химической промышленности. Благодаря отсутствию взаимодействия с другими элементами этот газ используется для получения сверхчистых веществ, а также для их анализа. В металлургической промышленности благородный газ позволяет обрабатывать такие металлы, как: титан, тантал, ниобий, бериллий, цирконий и др. Кроме этого, газ используется для перемешивания расплавленных веществ и снижения окисления хрома при производстве хромированной стали.
Способы получения аргона
Аргон является третьим по распространённости газом в земной атмосфере, поэтому наиболее логичным способом является добывание его из воздуха. Для этой цели используются специальные низкотемпературные ректификационные аппараты.
Процесс отделения инертного вещества осуществляется в такой последовательности:
- Воздух очищается от пыли и подвергается сжатию до жидкого состояния.
- Жидкий воздух, состоящий преимущественно из кислорода, азота и аргона подвергается ректификации.
- После отделения азота, из получившейся при сжатии жидкости, осуществляется доочистка кислородно-аргоновой смеси.
Температура кипения аргона в ректификационной установке составляет минус 185,3˚С. При этом, кислород кипит при температуре на 3 градуса выше, а азот – на 13˚С ниже этого показателя. По причине небольшого отличия в переходе из одного агрегатного состояния в другое, на первом этапе отделения аргона смесь содержит большое количество жидкого кислорода. На заключительной стадии получения аргона производится отделение благородного газа из кислородно-аргоновой смеси. Процесс доочистки, как правило, осуществляется с помощью электролитического водорода. В результате реакции в контактном аппарате с кислородом образуется водяной пар, который затем утилизируется через влагоотделитель.
Аргон может быть получен не только из атмосферного воздуха. При некоторых производственных процессах этот газ может являться сопутствующим продуктом. Например, при производстве аммиака, аргон является примесью азота и является совершенно ненужным элементом, поэтому полученный таким образом газ имеет очень низкую себестоимость, в сравнении с криогенным аргоном.
Правила хранения и транспортировки
Хранение и перевозка газа осуществляется в специальных металлических баллонах. Несмотря на то, что аргон является инертным газом, к ёмкостям всё равно предъявляются определённые технические требования, нарушение которых приведёт к невозможности использовать сосуд в дальнейшем. Кроме этого, утечка благородного газа в закрытом помещении может вызвать тошноту и потерю сознания у людей, ведь этот газ тяжелее воздуха и способен вытеснить необходимый для дыхания кислород.
Баллоны, используемые для хранения и транспортировки аргона, представляют собой цилиндрические ёмкости, которые могут быть разделены на следующие категории:
- Малого объёма: 0,4 – 12 л.
- Среднего объёма: 20 – 50 л.
- Большого объёма: более 50 л.
Стандартное давление в аргоновом баллоне составляет 150 атм, но в ёмкостях объёмом 40 литров разрешается хранить газ давлением до 200 атм. На ёмкости для хранения аргона наносится информация о дате изготовления и аттестации, а также такие параметры, как вес и объём.
Аргоновые баллоны имеют в верхней части горловины вентиль, с помощью которого можно надёжно перекрыть подачу газа, а также колпак, который защищает запорное устройство от механических повреждений.
Все баллоны, вне зависимости от объёма, окрашиваются в серый цвет и маркируются надписью «Аргон» зелёного цвета.
Транспортировка аргона должна осуществляться по правилам. Автомобили должны маркироваться специальным знаком, которые указывает на перевозку нетоксичных и невзрывоопасных веществ. Все документы оформляются в строгом соответствии с правилами ДОПОГ.
Кроме этого, при перевозке аргона необходимо:
- Надёжно закрепить баллоны.
- Размещение ёмкостей осуществляется в горизонтальной плоскости.
- Возможно вертикальное размещение только при наличии специальных приспособлений, повышающих устойчивость баллонов.
- Заправленные аргоном баллоны разрешается перевозить только при отсутствии утечек из ёмкости.
При перевозке аргона в количестве до 18 баллонов (объём 40 л) груз не является опасным, поэтому специальное разрешение не требуется. Тем не менее, даже при перемещении небольших партий следует придерживаться вышеописанных правил транспортировки ёмкостей с этим газом.
Аргон — самый распространённый инертный газ в земной атмосфере
- ГЛАВНАЯ
- Миссия компании DP Air Gas
- О КОМПАНИИ
- DP Air Gas
- Безопасность и качество
- Партнеры
- Пресс-центр
- Партнерская программа
- Вакансии
- Закупки и тендеры
- Ваше мнение
- ПРОДУКЦИЯ
- Азот
- Аргон
- Ацетилен
- Водород
- Гелий
- Двуокись углерода
- Кислород
- Пропан
- Пищевые смеси
- Сварочные смеси
- Лазерные смеси
- Жидкие газы
- Перечень продукции
- УСЛУГИ
- Аренда
- Доставка
- Ремонт
- Лаборатория
- Упаковка
- Аутсорсинг
- ОБОРУДОВАНИЕ
- КОНТАКТ
Аргон (общие сведения)

Аргон (общие сведения)
Аргон (общие сведения)
Краткая информация:
Аргон – элемент главной подгруппы 8-й группы 3-го периода периодической системы химических элементов Менделеева Д. И., с атомным номером 18.
Символ: Ar
Электронная конфигурация: 1s2 | 2s2 2p6 3s2 3p6
Температура кипения: -185,9 °C
Атомный номер: 18
Атомная масса: 39,948 ± 0,001 а. е. м.
Первооткрыватели: Уильям Рамзай, Джон Стретт (Лорд Рэлей)
Общие сведения об аргоне
Аргон является инертным одноатомным газом, не имеющим цвета, запаха, вкуса. В периодической системе химических элементов аргон обозначен символом Ar и имеет атомный номер 18. В общем объеме мирового вещества содержится около 0,02 % аргона. В природе аргон распространен в свободном виде, а не в соединениях. Атмосферный воздух содержит 0,93% аргона и является неиссякаемым источником его получения. Аргон также содержится в земной коре (1,2·10–4 %) и морской воде (0,45·10–4 %).
История открытия аргона
В 1892 году английский физик Джон Рэлей опытным путем обнаружил, что литр азота, полученный при переработке воздуха, весит больше, нежели литр азота, выделившийся в результате распада любого азотистого соединения. Рэлей, к тому времени несколько лет посвятивший изучению плотности газов вообще и азота в частности, вознамерился найти разгадку причин данного явления.
В журнале «Nature» им было опубликовано открытое письмо к ученым всего мира с описанием результатов проведенных опытов и предложением выдвинуть гипотезы касательно разницы в величинах плотности газа, полученного двумя различными способами. На данное письмо откликнулся известный английский химик Уильям Рамзай. Он предположил, что азот, выделившийся из воздуха, содержит неизвестный ранее газ более высокой плотности, чем азот.
Совместная работа двух ученых привела к получению абсолютно нового элемента. Измерения показали, что молекула полученного газа состоит лишь из одного атома, а значит данный газ является простым веществом.
В ходе проведенных исследований учеными было выяснено, что новый газ – самое инертное вещество из всех известных. Реакционная способность элемента по отношению к химически активным веществам практически полностью отсутствовала.
В 1894 году был сделан доклад об открытии нового элемента с описанием его свойств и способа его обнаружения. Ввиду полученной информации, председатель заседания – доктор Медан – внес предложение дать газу название «аргон», что в переводе с древнегреческого означает «неактивный, ленивый».
Свойства аргона
Физические свойства
Аргон относится к одноатомным газам. Он лишен цвета, вкуса и запаха. В нормальных условиях его плотность составляет 1,7839 кг/м3. В 100 мл воды комнатной температуры (20 °C) способно раствориться до 3,3 мл аргона. Температура кипения аргона составляет -185,9 °C, температура плавления же -189,3 °C.
Химические свойства
В настоящее время известны 2 химических соединения аргона: HArF и CU(Ar)O. Их можно получить и сохранить лишь при низких температурах.
Аргон не образует химических соединений, за исключением указанных выше, однако способен образовывать клатраты (соединения включения) с веществами, которые отличаются наличием водородных связей между молекулами. Атом аргона в данных соединениях помещается в созданную такими веществами кристаллическую решетку.
Аргон также способен образовывать эксимерные молекулы (они характеризуются устойчивостью возбужденных электронных состояний – когда вещество находится под действием электрического тока – и неустойчивостью состояний основных). К примеру, если провести через смесь хлора и аргона электрический ток, можно получить неустойчивое в обычных условиях соединение ArCl.
Получение аргона
Поскольку в атмосфере Земли содержится приблизительно 66*1013 тонн аргона, а при использовании этот газ не подвергается абсолютно никаким изменениям, можно считать его запасы на планете неисчерпаемыми. В крупной промышленности аргон образуется при разделении обычного воздуха на кислород и азот. Он является побочным продуктом и извлекается практически 99,99%-ой чистоты. Кроме того этот газ образуется при переработке отходов аммиачного производства.
Применение аргона
Являясь самым дешевым и доступным из благородных газов, аргон становится все более востребованным в сферах производства и потребления.
Аргон используется для заполнения ламп накаливания. Ранее для этих целей использовался чистый азот, однако переход к использованию смеси азота с аргоном позволил увеличить светоотдачу ламп. Кроме того, аргон используется и при производстве люминесцентных ламп.
В последние годы аргон получил широкое распространение в металлургической промышленности, а также в зависимых отраслях. Аргонная среда не допускает контакта расплавленного металла с иными газами и влажным воздухом при обработке плутония, титана, бериллия, циркония, щелочных и прочих металлов. Благодаря использованию электрической дуги в аргонной изоляции невероятно ускорился процесс резки металлов, и появилась возможность разрезать самые толстые листы тугоплавких металлов. Аналогичные защитные функции аргона используются при создании монокристаллов – полупроводников и сегнетоэлектриков.
Во время медицинских операций аргон часто используется для очистки пространства, поскольку не способен образовывать химические соединения в силу своей инертности.
Кроме того, аргон используется в качестве средства пожаротушения, для обработки сухих гидрокостюмов в дайвинге и даже в качестве пищевой добавки и как пропеллент для аэрозольных упаковок.
Интересные факты об аргоне
Под действием электрического тока аргон начинает испускать приятное ровное сине-голубое свечение.
Низкая теплопроводность аргона была отмечена и использована при производстве верхней одежды. Слой аргона в 4,5 мм позволяет с успехом заменить 14 мм твердых изоляторов. Закачивая газ в куртку, человек способен самостоятельно регулировать ее теплопроводность, увеличивая или уменьшая количество введенного вещества.
Одна тонна калия в течение одного года способна генерировать до 3100 атомов аргона. Поскольку в природных минералах, которые содержат калий, постоянно происходит накопление одного из стабильных изотопов аргона — 40Ar, появляется возможность измерить возраст существующих горных пород. Данный метод, называемый калий-аргоновым, широко применяется в области ядерной геохронологии.
В настоящее время ведущим поставщиком аргона в Украине является компания «DP Air Gas».
Аргон, Argon

История открытия аргона могла бы послужить основой для хорошего детектива. Сообщению об открытии нового газа поверили далеко не все химики. Усомнился в нем и сам Менделеев. Открытие аргона, казалось, могло привести к тому, что все «здание» периодической системы рухнет. Аргон не имел в таблице аналогов, ему вообще не находилось места в периодической системе: куда, скажите, можно поместить элемент, лишенный химических свойств?
Восемнадцатый элемент
Аргон относится к числу благородных газов, а история изобилует поистине драматичными моментами. В 1785 году английский химик и физик Г. Кавендиш обнаружил в воздухе какой-то новый газ, необыкновенно устойчивый химически. На долю этого газа приходилась примерно одна сто двадцатая часть объема воздуха. Но что это за газ, Кавендишу выяснить не удалось.
Об этом опыте вспомнили 107 лет спустя, когда Джон Уильям Стратт (лорд Рэлей) натолкнулся на ту же примесь, заметив, что азот воздуха тяжелее, чем азот, выделенный из соединений. Не найдя достоверного объяснения аномалии, Рэлей через журнал Nature обратился к коллегам-естествоиспытателям с предложением вместе подумать и поработать над разгадкой ее причин.
Спустя два года Рэлей и У. Рамзай установили, что в азоте воздуха действительно есть примесь неизвестного газа, более тяжелого, чем азот. Газ вел себя парадоксально: он не вступал в реакции с хлором, металлами, кислотами, щелочами, т.е. был абсолютно химически инертен. И еще одна неожиданность: Рамзай доказал, что молекула этого газа состоит из одного атома, — а до той поры одноатомные газы были неизвестны.
Когда Рэлей и Рамзай выступили с публичным сообщением о своем открытии, это произвело ошеломляющее впечатление. Многим казалось невероятным, чтобы несколько поколений ученых, выполнивших тысячи анализов воздуха, проглядели его составную часть, да еще такую заметную — почти процент! Кстати, именно в этот день и час, 13 августа 1894 года, аргон и получил свое имя (от греч. «аргос» — «ленивый», «безразличный»).
Сообщению об открытии нового газа поверили далеко не все химики, усомнился в нем и сам Менделеев. Открытие аргона, казалось, могло привести к тому, что все «здание» периодической системы рухнет. Атомная масса газа (39,9) указывала ему место между калием (39,1) и кальцием (40,1). Но в этой части таблицы все клетки были давно заняты. Аргон не имел в таблице аналогов, ему вообще не находилось места в периодической системе.
Поэтому официальное признание аргон получил лишь четверть века спустя — после открытия гелия. Теперь уже двум элементам не было места в периодической системе. После длительных дискуссий Менделеев и Рамзай пришли к выводу, что инертным газам нужно отвести отдельную, так называемую нулевую группу между галогенами и щелочными металлами.
Химическая инертность аргона (как и других газов нулевой группы) и одноатомность его молекул объясняются прежде всего предельной насыщенностью электронных оболочек.
Из подгруппы тяжелых инертных газов аргон самый легкий. Он тяжелее воздуха в 1,38 раза. Жидкостью становится при -185,9°С, затвердевает при –189,4°С (в условиях нормального давления). Молекула аргона одноатомна.
В отличие от гелия и неона, он довольно хорошо адсорбируется на поверхностях твердых тел и растворяется в воде (3,29 см 3 в 100 г воды при 20°С). Еще лучше растворяется аргон во многих органических жидкостях. Зато он практически нерастворим в металлах и не диффундирует сквозь них.
Под действием электрического тока аргон ярко светится, и сегодня сине-голубое свечение аргона широко используется в светотехнике.
Биологи нашли, что аргон благоприятствует росту растений. Даже в атмосфере чистого аргона семена риса, кукурузы, огурцов и ржи выкинули ростки. Лук, морковь и салат хорошо прорастают в атмосфере, состоящей из 98% аргона и только 2% кислорода.
На Земле и во Вселенной
На Земле аргона намного больше, чем всех прочих элементов его группы, вместе взятых. Его среднее содержание в земной коре (кларк) — 0,04 г на тонну, что в 14 раз больше, чем гелия, и в 57 — чем неона. Есть аргон и в воде, до 0,3 см 3 в литре морской и до 0,55 см 3 в литре пресной воды. Любопытно, что в воздухе плавательного пузыря рыб аргона находится больше, чем в атмосферном воздухе. Это потому, что в воде аргон растворим лучше, чем азот.
Главное «хранилище» земного аргона — атмосфера. Его в ней (по весу) 1,286%, причем 99,6% атмосферного аргона — самый тяжелый изотоп — аргон-40. Еще больше доля этого изотопа в аргоне земной коры. Между тем у подавляющего большинства легких элементов картина обратная — преобладают легкие изотопы.
В материи Вселенной аргон представлен еще обильнее, чем на нашей планете. Особенно много его в веществе горячих звезд и планетарных туманностей. Подсчитано, что аргона в космосе больше, чем хлора, фосфора, кальция, калия — элементов, весьма распространенных на Земле.
Как добывают аргон
Земная атмосфера содержит 66 • 1013 тонн аргона. Этот источник газа неисчерпаем. Тем более что практически весь аргон рано или поздно возвращается в атмосферу, поскольку при использовании он не претерпевает никаких физических или химических изменений. Исключение составляют весьма незначительные количества изотопов аргона, расходуемые на получение в ядерных реакциях новых элементов и изотопов.
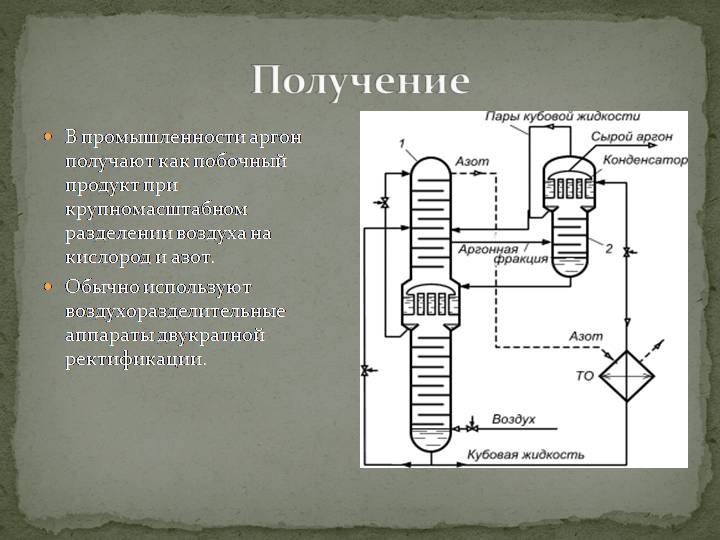
Получают аргон как побочный продукт при разделении воздуха на кислород и азот. Обычно используют воздухоразделительные аппараты двукратной ректификации, состоящие из нижней колонны высокого давления (предварительное разделение), верхней колонны низкого давления и промежуточного конденсатора-испарителя. В конечном счете азот отводится сверху, а кислород — из пространства над конденсатором.
Летучесть аргона больше, чем кислорода, но меньше, чем азота. Поэтому аргонную фракцию отбирают в точке, находящейся примерно на трети высоты верхней колонны, и отводят в специальную колонну. Состав аргонной фракции: 10–12% аргона, до 0,5% азота, остальное — кислород. В «аргонной» колонне, присоединенной к основному аппарату, получают аргон с примесью 3—10% кислорода и 3-5% азота. Дальше следует очистка «сырого» аргона от кислорода (химическим путем или адсорбцией) и от азота (ректификацией). В промышленных масштабах ныне получают аргон до 99,99%-ой чистоты. Аргон извлекают также из отходов аммиачного производства — из азота, оставшегося после того, как большую его часть связали водородом.
Нужный в хозяйстве «лентяй»
Как самый доступный и относительно дешевый инертный газ аргон стал продуктом массового производства, особенно в последние десятилетия.
Первоначально главным потребителем элемента №18 была электровакуумная техника. И сейчас подавляющее большинство ламп накаливания (миллиарды штук в год) заполняют смесью аргона (86%) и азота (14%). Переход с чистого азота на эту смесь повысил светоотдачу ламп. Поскольку в аргоне удачно сочетаются значительная плотность с малой теплопроводностью, металл нити накаливания испаряется в таких лампах медленнее, передача тепла от нити к колбе в них меньше. Используется аргон и в современных люминесцентных лампах для облегчения зажигания, лучшей передачи тока и предохранения катодов от разрушения.
Однако в последние десятилетия наибольшая часть получаемого аргона идет не в лампочки, а в металлургию, металлообработку и некоторые смежные с ними отрасли промышленности. В среде аргона ведут процессы, при которых нужно исключить контакт расплавленного металла с кислородом, азотом, углекислотой и влагой воздуха. Аргонная среда используется при горячей обработке титана, тантала, ниобия, бериллия, циркония, гафния, вольфрама, урана, тория, а также щелочных металлов. В атмосфере аргона обрабатывают плутоний, получают некоторые соединения хрома, титана, ванадия и других элементов (сильные восстановители).
Уже существуют металлургические цеха объемом в несколько тысяч кубометров с атмосферой, состоящей из аргона высокой чистоты. В этих цехах работают в изолирующих костюмах, а дышат подаваемым через шланги воздухом (выдыхаемый воздух отводится также через шланги); запасные дыхательные аппараты закреплены на спинах работающих.
Защитные функции выполняет аргон и при выращивании монокристаллов (полупроводников, сегнетоэлектриков), а также при производстве твердосплавных инструментов. Продувкой аргона через жидкую сталь из нее удаляют газовые включения. Это улучшает свойства металла.
Все шире применяется дуговая электросварка в среде аргона. В аргонной струе можно сваривать тонкостенные изделия и металлы, которые прежде считались трудносвариваемыми.
Не будет преувеличением сказать, что электрическая дуга в аргонной атмосфере внесла переворот в технику резки металлов. Процесс намного ускорился, появилась возможность резать толстые листы самых тугоплавких металлов. Продуваемый вдоль столба дуги аргон (в смеси с водородом) предохраняет кромки разреза и вольфрамовый электрод от образования окисных, нитридных и иных пленок. Одновременно он сжимает и концентрирует дугу на малой поверхности, отчего температура в зоне резки достигает 4000-6000°С. К тому же эта газовая струя выдувает продукты резки. При сварке в аргонной струе нет надобности во флюсах и электродных покрытиях, а стало быть, и в зачистке шва от шлака и остатков флюса.
Стремление использовать свойства и возможности сверхчистых материалов — одна из тенденций современной техники. Для сверхчистоты нужны инертные защитные среды, разумеется, тоже чистые; аргон — самый дешевый и доступный из благородных газов. Поэтому его производство и потребление росло, растет и будет расти.
Аргон горит или нет

Аргон не обладает токсичностью и не взрывоопасен, тем не менее, его высокая концентрация в воздухе может угрожать жизни человека. Дело в том, что в случае уменьшения кислородной объемной доли до значения ниже, может появиться кислородная недостаточность. А если произойдет значительное снижение объема кислорода, то это может грозить удушьем, потерей сознания, а в некоторых случаях может наступить смерть.
Вдыхание
Вдыхание аргона с концентрацией кислорода ниже заявленной нормы, может привести к асфиксии, головокружению и потере сознания.
Опасность пожарная
- Аргон – вещество негорючее, но при нагревании происходит повышение давления, что может привести к взрыву.
Кожные покровы
- Контакт с жидкостью может вызвать обморожение.
Контакт с глазами
- Если этот газ попадет в глаза, то это вызовет боль, может наступить неясность зрения и глубокие ожоги.
Опасность физическая
- Аргон в газообразном состоянии весит тяжелее воздуха, что дает ему возможность скапливаться в тех помещениях, в которых низкие потолки, тем самым, сокращая количество кислорода и вызывая его недостаток.
Уровень риска при вдыхании
- Утечка аргона из баллона может способствовать наступлению смерти от удушения. Это может быть связано значительным снижением в воздухе объема кислорода в замкнутом пространстве.
- Если объем аргона в воздухе будет превышать 70%, то человек может подвергнуться, так называемому, наркозу. В связи с тем, что этот газ тяжелее воздуха, это может привести к накоплению его в помещениях, которые трудно проветривать.
- Если требуется проводить работы в среде с аргоном, то в этом случае рекомендуется использовать противогазы и изолирующие приборы.
Аргон представляет собой одноатомный инертный газ, он не имеет вкуса, запаха и цвета. А в периодической таблице Менделеева порядковый номер аргона восемнадцатый. Стоит сказать , что этот газ в природных условиях распространен не в соединениях химического характера, а в свободном виде. Воздух нашей планеты содержит в себе 0,95 % аргона. Кстати, этот газ есть в морской воде и земной коре.

Аргон впервые был открыт в 1882 году Джоном Рэлеем, знаменитым английским физиком. Благодаря опытам и научным экспериментам Рэлей обнаружил, что переработанный литр азота более увесист, чем тот же литр вещества, полученного после распада азотистого соединения.
Опубликованное открытие позволило выдвинуть гипотезы о том, что имеются существенные разницы о величинах плотности газа, полученного двумя совершенно разными способами. Физики предположили что азот, выделившийся из воздуха, имеет в себе неизвестный газ с более высокой плотностью. Опыты продолжились, и позже был выделен аргон. Это самый инертный из газов, известных в девятнадцатом веке. В 1894 году учеными был сделан официальный доклад об аргоне и его свойствах.
Свойства аргона
Аргон является одноатомным газом. Он не имеет запаха, лишен цвета и вкуса. В стандартных атмосферных условиях плотность аргона составляет 1, 7839 кг/ м3. Примерно в ста миллилитрах обычной воды может раствориться около трех миллилитров аргона.
Температура кипения газа составляет минус 185 градусов по Цельсию, а температура плавления равна 189 градусам. У аргона имеется два химических соединения (HArF и CU(Ar)O). Эти соединения получаются при низкой минусовой температуре. Синтезируют аргон при помощи процедуры разделения воздуха на азот и кислород.
Применение газа
Аргон стоит довольно дешево и при этом он очень востребован в разнообразных промышленных сферах. Например, этот газ имеется в обычных лампах накаливания. Когда-то давно для этих целей использовался азот. Этот газ используется также в металлургической промышленности и в подобных смежных отраслях.
Плюс использования данного газа заключается в том, что он помогает не допустить вредный контакт металла с воздухом. Аргон используется в медицине. Он инертен, и это позволяет очищать инструменты, им также обрабатывают гидрокостюмы и используют как пропеллент для обычных аэрозольных упаковок.
В нашей компании вы можете купить аргон в баллонах с доставкой или самовывозом.
Меры безопасности
Аргон не взрывоопасен и не токсичен для человека. Но его высокая концентрация в воздухе может нанести вред человеку, так как может начаться кислородное голодание мозга, сопровождающееся потерей сознания и резкими головокружениями. Хоть аргон и не горючее вещество, но обращаться с ним надо аккуратно, так как при его нагревании повышается и его давление.

Контакт с жидкостью, содержащий аргон может вызвать серьезное обморожение конечностей. А при попадании аргона в глаза наступает потеря зрения, и появляются ожоги сетчатки. Поэтому при работе с аргоном следует обязательно носить защитную спецодежду и респираторы.
Следует помнить и о том, что аргон тяжелее воздуха в своем газообразном состоянии. И утечка газа из баллона может серьезно повлиять на физическое состояние человека. Обычно в промышленности при работе с аргоном используется шланговый противогаз или изолирующий прибор. Внимательно отслеживается уровень аргона в окружающем воздухе. По всем нормативам кислорода в помещении должно быть не менее девятнадцати процентов.
Общие сведения

Аргон — инертный одноатомный газ без цвета, вкуса и запаха. Третий по распространённости элемент в земной атмосфере (после азота и кислорода) — 0,93 % по объёму и 1,29 % по массе. Аргон — самый распространённый инертный газ в земной атмосфере, в 1 м 3 воздуха содержится 9,34 л аргона (для сравнения: в том же объеме воздуха содержится 18,2 см 3 неона, 5,2 см 3 гелия, 1,1 см 3 криптона, 0,09 см 3 ксенона). Есть аргон и в воде, до 0,3 см 3 в литре морской и до 0,55 см 3 в литре пресной воды. Его среднее содержание в земной коре (кларк) — 0,04 г на тонну, что в 14 раз больше, чем гелия, и в 57 — чем неона. Получается, что на Земле аргона намного больше, чем всех прочих элементов его группы, вместе взятых.
Содержание аргона в мировой материи оценивается приблизительно в 0,02 % по массе. Аргон (вместе с неоном) наблюдается на некоторых звездах и в планетарных туманностях. В целом его в космосе больше, чем кальция, фосфора, хлора, в то время как на Земле существуют обратные отношения.
Физические свойства
Аргон — одноатомный газ с температурой кипения (при нормальном давлении) -185,9 °C (немного ниже, чем у кислорода, но немного выше, чем у азота). Температура плавления -189,4°С. В 100 мл воды при 20 °C растворяется 3,3 мл аргона, в некоторых органических растворителях аргон растворяется значительно лучше, чем в воде.
Химические свойства
Название «аргон» (от греч.  — ленивый, медленный, неактивный) – подчеркивает важнейшее свойство элемента — его химическую неактивность.
— ленивый, медленный, неактивный) – подчеркивает важнейшее свойство элемента — его химическую неактивность.
Пока известны только 2 химических соединения аргона — гидрофторид аргона и CU(Ar)O, которые существуют при очень низких температурах. Кроме того, аргон образует эксимерные молекулы, то есть молекулы, у которых устойчивы возбужденные электронные состояния и неустойчиво основное состояние. Также со многими веществами, между молекулами которых действуют водородные связи (водой, фенолом, гидрохиноном и другими), образует соединения включения (клатраты), где атом аргона, как своего рода «гость», находится в полости, образованной в кристаллической решётке молекулами вещества-хозяина.
Получение
Получают аргон как побочный продукт при разделении воздуха на кислород и азот. Обычно используют воздухоразделительные аппараты двукратной ректификации, состоящие из нижней колонны высокого давления (предварительное разделение), верхней колонны низкого давления и промежуточного конденсатора-испарителя. В конечном счете азот отводится сверху, а кислород – из пространства над конденсатором. Летучесть аргона больше, чем кислорода, но меньше, чем азота. Поэтому аргонную фракцию отбирают в точке, находящейся примерно на трети высоты верхней колонны, и отводят в специальную колонну. Дальше следует очистка «сырого» аргона от кислорода (химическим путем или адсорбцией) и от азота (ректификацией).
Применение

Аргон находит широкое применение благодаря своему основному свойству – химической неактивности.
Первоначально главным потребителем аргона была электровакуумная техника . И сейчас подавляющее большинство ламп накаливания (миллиарды штук в год) заполняют смесью аргона (86%) и азота (14%). Переход с чистого азота на эту смесь повысил светоотдачу ламп. Поскольку в аргоне удачно сочетаются значительная плотность с малой теплопроводностью, металл нити накаливания испаряется в таких лампах медленнее, передача тепла от нити к колбе в них меньше. Используется аргон и в современных люминесцентных лампах для облегчения зажигания, лучшей передачи тока и предохранения катодов от разрушения.
Однако в последние десятилетия наибольшая часть получаемого аргона идет не в лампочки, а в металлургию .
Уже существуют металлургические цеха объемом в несколько тысяч кубометров с атмосферой, состоящей из аргона высокой чистоты. В этих цехах работают в изолирующих костюмах, а дышат подаваемым через шланги воздухом (выдыхаемый воздух отводится также через шланги); запасные дыхательные аппараты закреплены на спинах работающих.
В среде аргона ведут процессы, при которых нужно исключить контакт расплавленного металла с кислородом, азотом, углекислотой и влагой воздуха. Аргонная среда используется при горячей обработке титана, тантала, ниобия, бериллия, циркония, гафния, вольфрама, урана, тория, а также щелочных металлов. В атмосфере аргона обрабатывают плутоний, получают некоторые соединения хрома, титана, ванадия и других элементов.
Продувкой аргона через жидкую сталь из нее удаляют газовые включения. Это улучшает свойства металла.
Все шире применяется дуговая электросварка в среде аргона . В аргонной струе можно сваривать тонкостенные изделия и металлы, которые прежде считались трудносвариваемыми. При сварке в аргонной струе нет надобности во флюсах и электродных покрытиях, а стало быть, и в зачистке шва от шлака и остатков флюса. Аргон относится к инертным газам, которые химически не взаимодействуют с металлом и не растворяются в нем. Инертные газы применяют для сварки химически активных металлов (титан, алюминий, магний и др.), а также во всех случаях, когда необходимо получать сварные швы, однородные по составу с основным и присадочным металлом (высоколегированные стали и др.). Инертные газы обеспечивают защиту дуги и свариваемого металла, не оказывая на него металлургического воздействия.
Аргон используется в плазменной сварке и резке металлов как плазмообразующий газ. При микроплазменной сварке большинство металлов сваривают в непрерывном или импульсном режимах дугой прямой полярности, горящей между вольфрамовым электродом плазмотрона и изделием в струе плазмообразующего инертного газа – (чаще всего) аргона.
Электрическая дуга в аргонной атмосфере внесла переворот в технику резки металлов. Процесс намного ускорился, появилась возможность резать толстые листы самых тугоплавких металлов. Продуваемый вдоль столба дуги аргон (в смеси с водородом) предохраняет кромки разреза и вольфрамовый электрод от образования окисных, нитридных и иных пленок. Одновременно он сжимает и концентрирует дугу на малой поверхности, отчего температура в зоне резки достигает 4000-6000°С. К тому же, эта газовая струя выдувает продукты резки.
Поскольку аргон обладает низкой теплопроводностью его используют при заполнении внутреннего пространства стеклопакетов .
Защитные функции выполняет аргон и при выращивании монокристаллов (полупроводников, сегнетоэлектриков).
Стремление использовать свойства и возможности сверхчистых материалов – одна из тенденций современной техники. Для сверхчистоты нужны инертные защитные среды, разумеется, тоже чистые; аргон – самый дешевый и доступный из благородных газов.
Аргон высокой чистоты применяют в спектроскопических установках для анализа чистоты материалов и в аргоновых лазерах .
В пищевой промышленности аргон зарегистрирован в качестве пищевой добавки E938, в качестве пропеллента и упаковочного газа.
Используется аргон и в качестве огнетушащего вещества в газовых установках пожаротушения .
| Объёмная доля, % | Высший сорт |
| Аргон, не менее | 99,993 |
| Кислород, не более | 0,0007 |
| Азот, не более | 0,005 |
| Водяной пар, не более, что соответствует t насыщения аргона водяными парами при 760 мм рт. ст., 0° С, не выше | 0,0009 минус 61 |
| Сумма углеродсодержащих соединений в пересчёте на СО2, не более | 0,0005 |
| Объёмная доля, % | Высший сорт |
| Аргон, не менее | 99,998 |
| Кислород, не более | 0,0002 |
| Азот, не более | 0,001 |
| Водяной пар, не более | 0,0003 |
| Сумма углеродсодержащих соединений в пересчёте на СО2, не более | 0,00002 |
| Метан, не более | 0,0001 |
| Водород, не более | 0.0002 |
Хранение и перевозка аргона


Аргон газообразный хранится и транспортируется в баллонах окрашенных в серый цвет с надписью «АРГОН» зеленого цвета.
Аргон высокой чистоты хранится и транспортируется в баллонах окрашенных в серый цвет с надписью «АРГОН ВЫСОКОЙ ЧИСТОТЫ» белого цвета.
Аргон жидкий хранится и транспортируется в специальных криогенных емкостях.
Аргон сжатый и жидкий относится к классу опасных грузов. Поэтому транспорт используемый для перевозки аргона должен быть оборудован в соответствии с правилами перевозки опасных грузов.
Опасные факторы и меры безопасности
Инертные газы обладают физиологическим действием, которое проявляется в их наркотическом воздействии на организм. Наркотический эффект от вдыхания аргона проявляется только при барометрическом давлении свыше 0,2 МПа.
Содержание аргона в высоких концентрациях во вдыхаемом воздухе может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть от асфиксии (в результате кислородного голодания).
LiveInternetLiveInternet
- Регистрация
- Вход
—Метки
—Рубрики
- Атмосфера (12)
- Атмосфера Земли (9)
- Северное сияние (3)
- О Земле и Вселенной (11)
- Глава 2. Механика неба (9)
- Глава 1. Миры необыкновенной тяжести (2)
- Горы (6)
- Часть 1. Идея, название, структура (5)
- Новости науки! (4)
- Фотогалереи (1)
—Подписка по e-mail
—Постоянные читатели
- Все (1)
—Статистика
Аргон в составе атмосферы – содержание 1%.
 Содержание аргона в составе атмосферы Земли.
Содержание аргона в составе атмосферы Земли.
Аргон – инертный газ (благородный, редкий), третий по распространению (после азота (78%) и кислорода (21%)) в составе атмосферы. Инертными называются газы, состоящие из одного атома (для сравнения, кислород О 2 состоит из двух атомов) и практически не вступающие в реакцию ни с какими другими веществами. К инертным газам также относятся гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радиоактивный радон (Rn). В последнее время к этой группе также причисляют унуноктий (Uuo), синтез которого впервые был осуществлен только в 2002 году.
Содержание аргона в составе атмосферы Земли оценивается в 0,934 % по объему и 1,288 % по массе, а в количественном выражении — 4·10 14 т. Из всех инертных газов в составе земной атмосферы аргон наиболее распространен: в 1 м³ воздуха содержится 9,34 л аргона (для сравнения: в том же объеме воздуха содержится 18,2 см³ неона, 5,2 см³ гелия, 1,1 см³ криптона, 0,09 см³ ксенона).
Содержание аргона в литосфере Земли — 4·10 −6 % по массе. В каждом литре морской воды растворено 0,3 см³ аргона, в пресной воде его содержится 5,5·10 −5 — 9,7·10 −5 %. Его содержание в Мировом океане оценивается в 7,5·10 11 т, а в изверженных породах земной коры — 16,5·10 11 т
Образование и источники аргона.
Несмотря на различие количественного содержания инертных газов в атмосфере, все они имеют две отличительные особенности:
- Накопление этих газов в атмосфере необратимо, т.е. они практически не участвуют в биологических круговоротах Земли.
- Инертные газы образуются в результате радиоактивного распада определенных неустойчивых изотопов.
Инертные газы (в том числе и аргон) бывают двух типов:
Первичные – газы, захваченные Землей из космического пространства в период образования планеты. В природе встречаются очень редко. Первичный аргон представлен изотопами 36 Аr и 38 Аr, которые практически не входят в состав атмосферы Земли.
Радиогенные – газы, являющиеся продуктами распада естественных радиоактивных элементов (урана, тория, калия) в недрах планеты. В состав атмосферы входит радиогенный аргон, представленный изотопом 40 Аr. Радиогенный аргон образуется и накапливается в калийсодержащих земных породах в результате распада изотопа 40 К путем электронного захвата: 40 К + е → 40 Аr. Таким образом, объем накопленного аргона в породе зависит от возраста породы и количества калия в составе. (По тому же принципу содержание гелия в породах зависит от возраста породы и количества тория и урана.)
Как аргон попадает в атмосферу?
Аргон и гелий из недр земли попадают в атмосферу следующими способами:
- Во время извержений вулканов,
- Через трещины в земной коре в виде газовых струй,
- При выветривании горных пород.
На современном этапе развития Земли поступление аргона и гелия в атмосферу очень незначительно. Основная часть этих газов накапливается в земной коре. Исходя из этого, ученые сделали вывод, что весь аргон, содержащийся в атмосфере, поступил в нее на ранних этапах развития нашей планеты. В более позднее время в результате вулканической деятельности и в процессе выветривания горных пород состав атмосферы обогатился аргоном весьма незначительно.
Весь аргон, выделенный в атмосферу в течение геологического периода образования Земли, остался в пределах планеты, так как является довольно тяжелым газом (аргон тяжелее азота почти в полтора раза). (Для сравнения: гелий, являясь легким газом, практически весь улетучивался в космическое пространство, поэтому его содержание в составе атмосферы Земли весьма незначительно – около 5*10 -4 %).
Статьи по теме «Атмосфера»:
- Воздействие атмосферы на организм человека с увеличением высоты.
- Высота и границы атмосферы.
- Физические свойства атмосферы.
- Образование атмосферы. Первичная и вторичная атмосфера.
- Состав современной атмосферы Земли. Общие данные.
- Азот в составе атмосферы – содержание в атмосфере 78%.
- Кислород в составе атмосферы — содержание в атмосфере 21%.
- Углекислый газ в атмосфере.
- Аргон в составе атмосферы — содержание в атмосфере 1%.
- Вода в атмосфере.
Все, что Вы хотели знать об атмосфере Земли: высота, границы, свойства, воздействие на организм человека, образование, состав, части атмосферы, слои и многое-многое другое.
Аргон – самый ленивый газ
Содержание
- История открытия
- Способы получения
- Применение
- Применение в сварке
- Вредность и опасность
- Хранение и транспортировка
- Характеристики аргона
- Коэффициенты перевода объема и массы Ar при Т=15°С и Р=0,1 МПа
- Коэффициенты перевода объема и массы Ar при Т=0°С и Р=0,1 МПа
- Аргон в баллоне
- Давление аргона в баллоне при различной температуре
На данный момент известны изотопы аргона с массовыми числами от 29 до 54, но в в земной атмосфере он представлен тремя стабильными изотопами:
- 40 Ar (изотопная распространённость 99,600 %)
- 36 Ar (изотопная распространённость 0,337 %)
- 38 Ar (изотопная распространённость 0,063 %)
История открытия aргона
Аргон был открыт Джоном Уильямом Стреттом (John Strutt) и Сэром Уильямом Рамзаем (Sir William Ramsay) при исследовании азота, полученного из воздуха химическим путем. Несовпадение плотности этого газа при различных способах получения натолкнуло этих ученых на идею о присутствии в воздухе какого-то тяжелого инертного газа, который и был выделен ими в 1894 г. и назван argon, что с греческого переводится как «ленивый», «медлительный», «неактивный».
Способы получения аргона
Аргон получают как побочный продукт, при производстве кислорода и азота из воздуха методом низкотемпературной ректификации (см. получение аргона)
Применение аргона
Наиболее часто аргон применяют:
- как защитный газ при сварке;
- как плёнкообразующий газ при плазменной сварке и резке;
- для вытеснения кислорода и влаги из упаковки при хранении пищевых продуктов, что увеличивает срок их хранения (пищевая добавка Е938);
- как газ для тушения огня в некоторых системах пожаротушения.
Применение аргона в сварке
Аргон применяют в качестве защитной среды при сварке активных и редких металлов (титана, циркония и ниобия) и сплавов на их основе, алюминиевых и магниевых сплавов, а также хромоникелевых коррозионностойких жаропрочных сплавов, легированных сталей различных марок.

Для сварки черных металлов аргон обычно используются в смеси с другими газами — кислородом, гелием, двуокисью углерода или водородом.
Аргон, являясь более тяжелым, чем воздух, своей струей лучше защищает металл при сварке в нижнем положении. Растекаясь по поверхности свариваемого изделия, он защищает достаточно длительно довольно широкую и протяженную зону как расплавленного, так и нагретого при сварке металла.
Низкий ионизационный потенциал аргона помогает получить превосходный профиль сварочного шва и сохранять хорошую и устойчивую дугу от начала до конца. В тоже время, низкий потенциал ионизации является причиной и низкого напряжения на дуге, что снижает тепловую мощность дуги. Для более подробной информации рекомендуем статью о свойствах сварочной дуги в инертных газах — аргоне и гелии.
Применение аргона позволяет повысить температуру сварочной дуги, что улучшает проплавление сварного шва, увеличивая производительность сварки в целом. При этом проплавление приобретает «кинжальную» форму, что дает возможность выполнять однопроходную сварку в щелевую разделку металла больших толщин. При сварке в среде аргона (как и иных инертных газов) минимизируется выгорание активных легирующих элементов, что позволяет использовать более дешевые сварочные проволоки.

При TIG сварке аргон служит защитой не только для сварочной ванны от вредного воздействия воздуха, а также инертной защитой конца электрода.
Для дуговой сварки в целом аргон применяется гораздо чаще, чем гелий, однако при сварке листового алюминия толщиной менее 6 мм аргон рекомендуют смешивать с гелием, чтобы обеспечить нужную теплопроводность. В некоторых случаях аргонно-гелиевые смеси используют для зажигания дуги, после чего сварка происходит в присутствии гелия. Этот метод применяется для сварки толстолистового алюминия вольфрамовым электродом при постоянном токе.
Вредность и опасность аргона
Аргон не оказывает опасного воздействия на окружающую среду, но относится к асфиксантам (удушающий газ). Поскольку газообразный аргон тяжелее воздуха он может накапливаться в слабо проветриваемых помещениях у пола. При этом снижается содержание кислорода в воздухе, что вызывает кислородную недостаточность и удушье. Поэтому можно сделать вывод, что в больших количествах аргон вреден для организма человека.
Жидкий аргон – низкокипящая жидкость, которая может вызвать обморожение кожи и поражение слизистой оболочки глаз человека.
Хранение и транспортировка аргона
Газообразный и жидкий аргон поставляется по ГОСТ 10157. Хранят и транспортируют газообразный аргон в баллонах по ГОСТ 949 под давлением 15МПа.
Стальные баллоны должны соответствовать ГОСТ 949. Баллон окрашивается в серый цвет с зеленой полосой и зеленой надписью «АРГОН ЧИСТЫЙ».
Возможна транспортировка аргона в жидком виде в специальных цистернах или сосудах Дьюара с последующей его газификацией.

Характеристики аргона
Характеристики Ar представлены в таблицах ниже:
Аргон
Ar, химический элемент VIII гр. периодической системы Менделеева, относится к инертным газам (См. Инертные газы); атомный номер 18, атомная масса 39,948. При обычных условиях А. — газ без цвета, запаха и вкуса. К открытию А. привело обнаруженное в 1892 Дж. Рэлеем (См. Рэлей) превышение на 0,0016 г/л (при 0°С и 101 325 н/м 2 ) плотности азота из воздуха по сравнению с плотностью азота, полученного из его соединений. В 1894 Рэлей и У. Рамзай выделили из азота воздуха газ, обладающий химической инертностью (греч. argys — бездеятельный). После открытия других инертных газов они были объединены в отдельную нулевую группу периодической системы; теперь общепринято рассматривать их как главную подгруппу VIII гр.
В природе А. присутствует только в свободном виде. Атмосфера содержит 16-10 12 т А., земная кора 0,165·10 12 т, вода 0,752·10 12 т. Объёмная концентрация А. в воздухе 0,93%. Атмосферный А. состоит из трёх стабильных изотопов: 36 Ar (0,337% ), 38 Ar (0,063% ) и 40 Ar (99,600% ). Преобладание тяжёлого изотопа связано с его образованием при радиоактивном распаде природного калия (См. Калий) 40 K (в результате общее количество А. в атмосфере непрерывно возрастает). Вследствие высокого содержания 40 Ar атомная масса Ar больше, чем у следующего за ним в таблице Менделеева К. Из искусственно полученных радиоактивных изотопов А. для радиоактивной метки наиболее пригоден 37 Ar с периодом полураспада 35,0 дней. Плотность А. (при 0°С и 101 325 н/м 2 ) 1,7839 кг/м 3 , tпл —189,3°C, tkип —185,9°C. В 1 л воды при нормальных условиях растворяется 51,9 см 3 А. В металлах А. практически не растворим. Молекула А. одноатомна. Энергия первичной ионизации А. велика (15,755 эв или 2,5241·10 -18 адж), сродством к электрону А. не обладает. Все попытки получить валентные соединения А. оканчивались неудачей. А. способен образовывать Соединения включения (клатраты) с веществами, имеющими в своих кристаллических решётках полости с размерами, приблизительно соответствующими диаметру атома А. (H2O, D2O, фенол, гидрохинон). Наиболее полно изучен Ar·6H2O, впервые синтезированный в 1896 П. Вийаром при кристаллизации воды в атмосфере А. (давление А. 15,5 Мн/м 2 ). температура разложения Ar·6H2O при 101 325 н/м 2 42,0°C. А. с фенолом даёт соединение Ar·3С6Н5ОН. В соединениях включения, например в SO2·6H2O, можно SO2 изоморфно заместить Ar (работы Б. А. Никитина и др.), что даёт возможность синтезировать Ar·6H2O при нормальном давлении.
В промышленности А. получают в процессе разделения воздуха при глубоком охлаждении. Возможно получение А. из продувочных газов колонн синтеза аммиака. Отделять А. от других инертных газов лучше всего газохроматографическими методами. А. широко используется при термической обработке легко окисляющихся металлов. В защитной атмосфере из А. проводят, например, сварку и резку различных редких и цветных металлов, плавку Ti, W, Zr и т.д. В атмосфере А. выращивают кристаллы полупроводниковых материалов. А. заполняют электрические лампочки (А. снижает скорость испарения вольфрама и позволяет увеличить светоотдачу). Аргоновые трубки применяют для рекламы (сине-голубое свечение). На определении отношения 40 Ar : 40 K. основан один из методов определения возраста минералов (см. Геохронология). Радиоактивный А. иногда применяют для контроля вентиляционных систем.
Лит: Фастовский В. Г., Ровинский А. Е., Петровский Ю. В., Инертные газы, М., 1964; Головко Г. А., Аппараты и установки для производства аргона, М.—Л., 1965; Финкельштейн Д. Н., Инертные газы, М., 1961; Бердоносов С. С., Инертные газы вчера и сегодня, М., 1966.
Атмосфера Земли — Аргон в составе атмосферы Земли – содержание в атмосфере 1%.
 Содержание аргона в составе атмосферы Земли.
Содержание аргона в составе атмосферы Земли.
Аргон – инертный газ (благородный, редкий), третий по распространению (после азота (78%) и кислорода (21%)) в составе атмосферы. Инертными называются газы, состоящие из одного атома (для сравнения, кислород О 2 состоит из двух атомов) и практически не вступающие в реакцию ни с какими другими веществами. К инертным газам также относятся гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радиоактивный радон (Rn). В последнее время к этой группе также причисляют унуноктий (Uuo), синтез которого впервые был осуществлен только в 2002 году.
Содержание аргона в составе атмосферы Земли оценивается в 0,934 % по объему и 1,288 % по массе, а в количественном выражении — 4·10 14 т. Из всех инертных газов в составе земной атмосферы аргон наиболее распространен: в 1 м³ воздуха содержится 9,34 л аргона (для сравнения: в том же объеме воздуха содержится 18,2 см³ неона, 5,2 см³ гелия, 1,1 см³ криптона, 0,09 см³ ксенона).
Содержание аргона в литосфере Земли — 4·10 −6 % по массе. В каждом литре морской воды растворено 0,3 см³ аргона, в пресной воде его содержится 5,5·10 −5 — 9,7·10 −5 %. Его содержание в Мировом океане оценивается в 7,5·10 11 т, а в изверженных породах земной коры — 16,5·10 11 т
Образование и источники аргона.
Несмотря на различие количественного содержания инертных газов в атмосфере, все они имеют две отличительные особенности:
- Накопление этих газов в атмосфере Земли необратимо, т.е. они практически не участвуют в биологических круговоротах Земли.
- Инертные газы образуются в результате радиоактивного распада определенных неустойчивых изотопов.
Инертные газы (в том числе и аргон) бывают двух типов:
Первичные – газы, захваченные Землей из космического пространства в период образования планеты. В природе встречаются очень редко. Первичный аргон представлен изотопами 36 Аr и 38 Аr, которые практически не входят в состав атмосферы Земли.
Радиогенные – газы, являющиеся продуктами распада естественных радиоактивных элементов (урана, тория, калия) в недрах планеты. В состав атмосферы входит радиогенный аргон, представленный изотопом 40 Аr. Радиогенный аргон образуется и накапливается в калийсодержащих земных породах в результате распада изотопа 40 К путем электронного захвата: 40 К + е → 40 Аr. Таким образом, объем накопленного аргона в породе зависит от возраста породы и количества калия в составе. (По тому же принципу содержание гелия в породах зависит от возраста породы и количества тория и урана.)
Как аргон попадает в атмосферу Земли?
Аргон и гелий из недр земли попадают в атмосферу следующими способами:
- Во время извержений вулканов,
- Через трещины в земной коре в виде газовых струй,
- При выветривании горных пород.
На современном этапе развития Земли поступление аргона и гелия в атмосферу очень незначительно. Основная часть этих газов накапливается в земной коре. Исходя из этого, ученые сделали вывод, что весь аргон, содержащийся в атмосфере, поступил в нее на ранних этапах развития нашей планеты. В более позднее время в результате вулканической деятельности и в процессе выветривания горных пород состав атмосферы обогатился аргоном весьма незначительно.
Весь аргон, выделенный в атмосферу Земли в течение геологического периода образования Земли, остался в пределах планеты, так как является довольно тяжелым газом (аргон тяжелее азота почти в полтора раза). (Для сравнения: гелий, являясь легким газом, практически весь улетучивался в космическое пространство, поэтому его содержание в составе атмосферы Земли весьма незначительно – около 5*10 -4 %).
Это была статья « Аргон в составе атмосферы Земли — содержание в атмосфере 1%. » Далее читайте « Вода в атмосфере Земли и гидрологический цикл. «






 Содержание аргона в составе атмосферы Земли.
Содержание аргона в составе атмосферы Земли. Содержание аргона в составе атмосферы Земли.
Содержание аргона в составе атмосферы Земли.
