Гидратация цементов как химический процесс. Фазовый состав продукции твердения
Гидратация цементов как химический процесс. Фазовый состав продукции твердения
При гидратации алита протекает реакция, которая в общем виде может быть записана следующим образом:
Значения коэффициентов x, y, m меняются в зависимости от внешних условий протекании реакций гидратации, главным образом от температуры. Гидратация белита протекает по аналогичной схеме с образованием гидросиликатов того же состава:
При нормальной температуре продуктом гидратации алита и белита является один и тот же гидросиликат, обозначаемый СН(П) или С2SН2. Кроме гидросиликата в достаточно большом количестве образуется кристаллический Са(OН)2, причем при гидратации алита его образуется значительно больше, чем при гидратации белита. При повышении температуры до 100-110°С образуется тот же гидросиликат СSН(П), но с более высоким содержанием оксида кальция. При 70-80°С основность (отношение числа молей CaO к SiO2) гидросиликатов достигает предельного значения, равного 2. Гидросиликат CSH(П) — первая гидросиликатная фаза, образующаяся при более высоких температурах. Затем он превращается в гидросиликат, обозначенный C2SH(А), или a — гидрат C2S. Температурный интервал устойчивости этого гидросиликата — I25 -175°С. При более высоких температурах он переходит в гидросиликат C2SH(С) (g — гидрат С2). При температурах, выше 160°C может образовываться гидросиликат C3SH2. При температурах выше 125°С также образуется гидросиликат С2SН(B), называемый гиллебрандитом. Размеры гидросиликатов, образующихся при повышенных температурах, более крупные, чем размеры кристаллов, образующихся при низких температурах.
Таким образом, при гидратации силикатных клинкерных минералов образуется, главным образом, высокоосновные гидросиликаты кальция, имеющие мольное отношение Cao/SiO2 более 1,5. Однако эти гидросиликаты обладают большей растворимостью и высокой константой скорости растворения, поэтому в плане обеспечения долговечности крепи скважины они не являются оптимальными.
При повышенных температурах растворимость кремнеземистых компонентов возрастает, и растворенныйSiO2 связывает гидрооксид кальция с образованием, гидросиликатов пониженной основности. Уменьшение содержания свободного гидрооксида кальция в растворе также способствует снижению основности. Уменьшение содержания свободного гидрооксида кальция в растворе также способствует снижению основности продуктов твердения и повышению их долговечности и прочности. Поэтому для крепления интервалов с высокими температурами требуется введение в состав тампонажных портландцементов кремнеземсодержащих материалов, шлаков, золы, молотого песка и т.д.
Согласно схемы, предложенной Я. Скальни и Дж. Янгом, механизм гидратации трехкальциевого силиката представляется следующим образом: C2S реагируют c dодой сразу же при контактировании. Во время: индукционного периода происходит обмен ионов между раствором и твердым непрогидратированным веществом, способствуя автокаталитическому увеличению скорости реакции. При этом большое количество продуктов гидратации с низкой плотностью и увеличенным объемом по сравнению с негидратированной фазой осаждается на покрытую водой поверхность минерала. Это обусловливает общее увеличение пористости, системы, что, в свою очередь, снижает перенос ионов на поверхность раздела между твердым веществом и жидкостью, замедляя процесс гидратации. Этот период рассматривается как контролируемая диффузией стадия гидратации.
В начале, гидратации происходит реакции:
где: «C2S» это структура C3S .с, дефицитом гидрооксида кальция.
В конце индукционного периода — реакции:
В целом механизм гидратации разделен на пять отдельных стадий.
Стадия 1. При контакте С2 с водой имеет место гидролиз сопровождающийся переходом протона О 2- в OH — , в и Са 2+ в Са 2+ + а q. Гидролиз происходит в основном на активных участках. В результате перехода в раствор Са 2+ на этих участках минерала образуется поверхностный слой продуктов реакции, представляющих собой группировки силикатных ионов и , связанных между собой водородными связями и несколькими ионами кальция. Образовавшийся аморфный слой имеет тенденцию к всасыванию воды и набуханию, подобно осмотическому процессу. Равновесие заряда поддерживается переходом ионов Са 2+ и ОН — в раствор, компенсируя ионы Н + имеющиеся в растворе при гидролизе воды. Между подвижным ионом — Са 2+ и неподвижной поверхностью силикатные ионов образуют двойной электрический слой, обеспечивая хемосорбцию.
Стадия 2. Вследствие дальнейшего перевода в раствор ионов Са 2+ и OН — с образовавшийся на 1 стадии поверхностный слой продолжает разрываться. Образующийся двойной электрический слой замедляет скорость его развития. Из находящихся в растворе групп атомов будут формироваться зародыши кристаллов Са(OН)2 или C-S-H.
Стадия 3. По мере перевода ионов в раствор, содержание их становится достаточные для роста зародышей кристаллов. Первоначально рост отмечается при пресыщении раствора относительно гидрооксида кальция. Вследствие возникающих больших сопротивлений через слой новообразованного диоксида кремния на поверхности образуются слаборазвитые кристаллы C-S-H.
Стадия 4 и 5. На этих стадиях продолжается дальнейший рост изообразныхкристаллов C-S-H. При этом образующиеся на ранее сформированных кристаллах C-S-H новые кристаллы будут отличаться по морфологии, поскольку содержание ионов в растворе меняется. Это и обуславливает наличие различных модификаций гидросиликатов.
Механизм гидратации b — С2S аналогичен и отличается в уменьшении степени пересыщения раствора ионами Са 2+ относительно Са(ОН)2 и низкой экзотермией процесса гидратации.
Общий состав и морфология С — S — Н, формирующихся из b — С2S и C3S оказываются сходными. Низкая степень насыщения раствора гидрооксидом кальция при гидратации b — С2S обуславливает формирование более крупных кристаллов Са(ОН)2 по сравнении с кристаллами, образующимися при гидратации C3S.
Гидратация С3А. Процесс гидратации С3А определяется скоростью диффузии жидкой фазы через слой сформировавшихся в начальной стадии гидратов С4АН13 и С2АН8. Так как гидратация СА сопровождается большим выделением теплоты, указанные гидраты быстро переходят в С3АН6.
Образовавшиеся гидраты С4АН13, С4АС5Н12 и их твердые растворы создают изолирующий слой на поверхности зерен С3А, который резко замедляет, но не прекращает, переток реагирующих ионов и молекул воды. Этот поток не обеспечивает растворение нижнего слоя, контактирующего с поверхностью, и поэтому; последовательное образование С4АН13 истощает раствор, находящийся в контакте с зернами С3А относительно ионов Са 2+ , тем самым способствует осаждению Аl(ОН) 3 . Этот процесс выражается:
Разрушение изолирующего слоя вследствие превращения С4АН13 и С2АН8 в С2АН6 будет вызывать при высоком содержании в растворе ионов Са + и ОН — также и разрушение, слоя Аl(ОН)3,что будет обуславливать дальнейшую гидратацию С3А. Последовательность этих реакций следующая:
Состав продуктов гидратации алюминатных составляющих цемента также зависит от температуры окружающей среды. При нормальной температуре взаимодействие с водой трехкальциевого алюмината происходит по схеме:
В реакцию вступает гидрооксид кальция, выделяющийся при гидратации силикатных минералов. При повышенных температурах (более 50 — 60°С) основным продуктом гидратации является шестиводный гидроалюминат:
При пониженных температурах (ниже 10° С) при гидратации алюминатов предпочтительно образование низкоосновных гидроалюминатов
Гидратация алюмоферритной фазы. При температуре ниже 20°С гидратация алюмоферритов кальция сопровождается образованием гидрата четырехкальциевого алюмоферрита кальция.
При температурах свыше 20 °С данный кристаллогидрат превращается в кубический,
а при температурах выше 50°С только в кубический. Присутствующий в растворе гидрооксид кальция замедляет переход гексагональной формы кристаллогидрата в кубическую.
Реакции взаимодействия алюмоферритов кальция различного состава выражаются следующим образом:
Твердые растворы трехкальциевых гидроалюмоферритов кристаллизуются в кубической сингонии и по своей структуре подобны минералам гранатовой группы — гроссуляру и андрадиту .
При взаимодействии с водой полиминеральных цементов, содержащих силикаты, алюминаты и ферриты кальция, образуются твердые растворы гидроалюмоферритов и алюможелезистых гранатов по сложной системе:
В этих твердых растворах одна молекулаSiO2 замещается двумя молекулами Н2О и поэтому растворы называются гидрогранатами. Вся группа соединений имеет общую формулу:
или . Гидрогранаты повышают долговечность тампонажного камня, т. к. имеют большую стойкость ко многим видам пластовых вод.
Кроме указанных минералов портландцемент содержит в своем составе сульфат кальция в виде гипса, вводимого для замедления скорости схватывания цементного теста. Механизм замедления представляется следующим образом.
Продукт гидратации алюмината и алюмоферрита кальция — шестиводный гидроалюминат кальция в присутствии гипса образует гидросульфоалюминат кальция трехсульфатной формы по реакции:
который можно записать как . Это соединение называется эттрингитом и для него характерно сильное приращение объема и высокая удельная поверхность. Быстрообразующийся эттрингит покрывает зерна клинкерных минералов, затрудняя к ним доступ воды. Процесс гидратации замедляется. После того, как весь гипс расходуется на химическую реакцию и концентрация ионов в растворе понижается эттрингит становится термодинамически неустойчивым и переходит в моносульфатную форму гидросульфоалюмината кальция. Доступ воды к минералам клинкера открывается и процесс гидратации интенсифицируется.
Ферритные составляющие в присутствии гипса образуют гидросульфоферриты моно- и трехсульфатной формы, аналогичные гидросульфоалюминатам кальция с общими формулами:
При высоких температурах (выше 50°С) высокосульфатные формы указанных соединений переходят в моносульфатные, которые, в свою очередь, при температурах выше 100°С разлагаются с выделением гипса и гидрогранатов.
Изложенные ранее материалы позволяют заключить, что процесс гидратации, является частным случаем сольвации и представляет собой процесс взаимодействия веществ с водой, при котором молекулы воды присоединяются к веществу, не разрушаясь.
Образующиеся соединения определенного состава в этом случае называются кристаллогидратами. Гидратация вызвана в основном донорно — акцепторным, диполь — дипольным, ион — дипольным взаимодействием между частицами, а также образованием водородных связей.
Различают гидратацию твердых веществ с образованием гидратов, гидратацию оксидов, гидратацию электролитов в растворах, гидратацию молекул в растворах, а также гидратацию органических и высокомолекулярных соединений. В процессе гидратации происходит выделение тепла — теплота гидратации. Она вызвана смачиванием и реакцией.
В составе кристаллогидратов молекулы воды входят в виде индивидуальных частиц и поэтому в химических формулах воду обычно пишут отдельно, например, , и т.д.
Известные кристаллогидраты подразделяются на кристаллогидраты определенного состава и неопределенного. Во-первых на одну молекулу вещества приходится определенное количество молекул воды, например, . Для вторых характерно неопределенное число молекул воды, приходящихся на одну молекулу вещества, изменяющихся в зависимости от температуры, давления водяных паров в пространстве, концентрации растворенного вещества и т.д. Вода, находящаяся в составе кристаллогидратов, называется кристаллизационной. Она располагается в определенном порядке. Вода, заполняющая пустоты и пространства кристалла и удерживаемая им электрическими силами называется цеолитной. Ее удаление сопровождается разрушением кристалла. Вода, пошедшая на образование гидрооксидов называется конституционной. При их образовании происходит разложение молекул воды.
Гидратация цемента

Данная химическая реакция является основополагающим химическим процессом, благодаря которому мы с вами можем видеть окружающие нас здания и конструкции, дороги и тротуары и огромное число других сооружений. В этой статье мы с вами рассмотрим процесс гидратации цемента и его основные аспекты и постараемся объяснить его простыми словами.
Процесс гидратации цемента
Конечным результатом данной химической реакции является образование цементного камня. Это происходит благодаря смешению цементного клея с водой. Их взаимодействие образует кристаллогидраты, которые образуют кристаллическое соединение, удерживающее частицы и молекулы применяемого сыпучего компонента (щебень, гравий, песок и т.д.).
Как мы с вами знаем, первоначальным этапом набора прочности и сушки цемента является схватывание. Во время этого процесса происходит образование пространственных связей между молекулами. За это отвечают иглообразные кристаллы, получаемые при смешивании воды и цемента. Спустя примерно 10 часов после замеса, начинается застывание, выраженное в формировании силикатной структуры.
Спустя 28 суток образуется силикатная структура максимальной прочности (в зависимости от марки.
Стоит отметить, что несмотря на то, что реакция является экзотермической (выделяется тепло), очень важно соблюдение подходящих температурных условий. Нарушение температурного режима приведёт к снижению эксплуатационных свойств бетонной смеси. Из за этого могут появиться трещины, разрушения и дефекты.
Степень гидратации цемента напрямую зависит от соотношения воды и цемента в смеси. Она достигает своего пика в течении 1-5 лет.
Как можно повлиять на гидратацию цемента?
При строительстве во время холодного времени года, когда среднесуточная температура ниже, чем нужно для хорошего схватывания, допускается использование специализированных добавок. Компания Полихим предлагает вам несколько решений и положительных дополнений к вашему бетону:
- Противоморозные добавки – такие вещества повышают температуру смеси, предотвращая замерзание;
- Ускорители тверденияи набора прочности – ускорят процесс твердения, что позволит сократить время на строительные работы;
- Замедлители схватывания – предотвращают преждевременное застывание цементной и бетонной смеси. Это позволит выделить необходимое количество времени для завершения физико-химических процессов.
Другие статьи:
Статья расскажет вам о том, что такое подвижность бетонной смеси, как её определить и на какие свойства бетонной смеси она влияет.
В этой статье поговорим о том, почему же крошится бетон и как этого избежать.
В статье мы обсудим гидроизоляцию бетона, узнаем зачем она нужна и какие на сегодняшний день существуют средства защиты бетона от влаги
Фазовые изменения продуктов гидратации шлакощелочных цементов при нагревании
Вещественный состав продуктов гидратации шлакощелочных цементов весьма разнообразен. Он определяется минералогическим и химическим составом шлаков и заполнителей, природой щелочного компонента, условиями твердения и возрастом бетона.
Термодинамический расчет, выполненный В. А. Ракшей [40] для вяжущих систем шлак — гидроокись натрия, твердеющих в нормальных условиях и в условиях пропаривания, позволил ограничить круг веществ, формирующих искусственный конгломерат, и выделить определяющие его структуру и свойства стабильные гидратные фазы новообразований.
Согласно расчетам (табл. 17), которые позволяют оценить вероятность образования того или иного продукта в системе при оптимальном расходе щелочного компонента по величине изобарно-изотермического потенциала, наиболее предпочтительными фазами при твердении композиций шлак основной +NaOH наряду с низкоосновными гидросиликатами кальция являются кальциевый цеолит жисмондин, а при твердении смесей — шлак нейтральный и кислый +NaOH — щелочной гидроалюмосиликат типа анальцима. Поскольку при твердении шлакощелочных бетонов едкий натр вступает во взаимодействие не только со шлаковой составляющей цемента, но и с заполнителем, был проведен расчет изобарно-изотермического потенциала для системы, имитирующей твердение вяжущего в составе бетонной смеси, содержащей свободный кремнезем (табл. 18).
Сравнительная оценка величин изобарно-изотермического потенциала, полученных при расчете таких систем, свидетельствует о том, что, как и в предыдущем случае, для вяжущих на основных шлаках предпочтительным является образование жисмондина, на нейтральных — анальцима, а на кислых — парагонита или анальцима. Небольшая разница в величинах изобарно-изотермических потенциалов позволяет предположить возможность образования наряду с жисмондином и парагонитом анальцима.
При наличии в системе шлак основной +NaOH глинистых минералов в составе возникающих гидроалюмосиликатов наряду с жисмондином вместо щелочного силиката может кристаллизоваться анальцим.
Жисмондин в этой системе замещается анальцимом в том случае, если в качестве щелочного компонента используются карбонат или силикат натрия, связывающие избыточную окись кальция основного шлака, в результате катионного обмена соответственно, в карбонаты или гидросиликаты кальция При повышенном содержании щелочей в рассматриваемых вяжущих системах также создаются условия для предпочтительного формирования в составе гидроалюмосиликатов анальцима, в том числе и в системе шлак основной +NaOH.
Следует отметить, что наряду с перечисленными основными фазами в составе продуктов твердения таких композиций, по данным рентгеноструктурного анализа, образуются и другие гидратные новообразования, которые можно отнести к промежуточным нестабильным веществам, переходящим со временем в стабильные минеральные образования типа слюд, анальцима, жисмондина.
Возникшие в процессе твердения шлакощелочных цементов гидраты при нагревании до 1000°С претерпевают изменения, которые, в конечном счете, выражаются в их дегидратации и последующей перекристаллизации в безводные минеральные образования. В частности, кальциевые гидросиликаты кристаллизуются в волостанит, анальцим переходит в нефелин, а затем при наличии в системе реакционного кремнезема — в полевой шпат.
Отсутствие заметных нарушений структурных связей в синтезированном камне в течение многих теплосмен позволили Я. И. Соловьеву [64] рекомендовать бетоны на шлакощелочных цементах и шлаковой пемзе, как жаростойкие материалы, повышенная термостойкость которых обеспечивается близостью коэффициентов температурного расширения вещества формирующихся новообразований и шлаковых заполнителей.
Эти свойства присущи и продуктам взаимодействия едких щелочей с алюмосиликатным веществом заполнителя или активных минеральных добавок.
Так, щелочные алюмосиликаты состава R2O·Al2O3·(2—6)SiO2·nH2O, синтезирующиеся в бетоне в результате взаимодействия каолина, бентонита, часовоярской глины и кремнезема с едкими щелочами в условиях сушки, пропаривания, при атмосферном и повышенном давлениях, а затем обжига, по данным Ж. В. Скурчинской, претерпевают стадийные изменения [13—15, 37, 42]. Примером этого может служить процесс силикатообразования в системе: каолин — кремнезем — едкий натр (рис. 11) состава Na2O·Al2O3·6SiO2, в которой определенной температуре и виду обработки свойственны конкретные кристаллические новообразования. Так, при сушке и пропаривании в такой системе, по данным рентгеноструктурного анализа, кристаллизуется вещество d = 6,38; 3,68; 2,79; 2,60; 2,12 Å состава Na2O·Al2O3·2SiO2·nH2O типа гидратной фазы нефелинового состава, в которую в качестве клатратной составляющей входит вода, а увеличение времени изотермического прогрева приводит к возникновению натролита состава Na2O·Al2O3·3SiO2·nH2O с d =5,80; 4,81; 4,44; 2,85; 2,58; 1.82 Å; результатом автоклавной обработки является кристаллизация анальцима состава Na2O·Al2O3·4SiO2·nH2O с d = 5,64; 3,45; 2,68; 1,90 Å.
Дальнейший подъем температуры приводит к дегидратации гидратной фазы, устойчивой до температуры 700—800° С, и разрушению ее кристаллической структуры. В результате вещество аморфизуется. В интервале температур 850—900° С независимо от содержания кремнезема (2—4 молекулы Si02) в составе вмещающей его гидратной фазы кристаллизуется безводный щелочной алюмосиликат типа нефелина состава Na2O·Al2O3·2SiO2 с d = 4,20; 3,85; 3,02; 2,89; 2,58; 2,45; 2,12 Å. Увеличение времени выдержки при этой температуре или дальнейшее ее повышение до 1000°С влечет за собой исчезновение линий кремнезема (d = 4,30; 3,35; 1,82 Å) и кристаллизацию вещества типа альбита, состава Na2O·Al2O3·6SiO2 с d = 6,38; 4,11; 3,84; 3,21; 2,95; 2,55; 2,31; 2,21 Å, аналогичного природному.
В области температур 1100—1150°С происходит плавление новообразований и система переходит в стекловидное состояние.
В смесях на часовоярской глине [14, 37] формируются щелочные алюмосиликатные связки того же вещественного состава.
В случае контакта со щелочами глинистых грунтов, представленных монтмориллонитовыми минералами, зафиксировать кристаллизацию гидратной фазы нефелинового состава в смесях, подвергнутых сушке, не удалось. Гидратными продуктами их взаимодействия в гидротермальных условиях является акальцим, переходящий при нагревании в температурном интервале 600—750°С в альбит.
Процесс силикатообразования в системе каолин — едкий натр [14, 19] состава Na2O·Al2O3·2SiO2 также протекает стадийно (рис. 12). В результате сушки при температурах 100—300°С кристаллизуется гидратная фаза нефелинового состава, структура которой начинает разрушаться при температуре 750°С, о чем свидетельствует уменьшение интенсивности линий с d = 6,38; 3,68; 2,85; 2,60; 2,13 Å на рентгенограмме. Дальнейшее повышение температуры вплоть до 1100°С не приводит к структурным изменениям полученной фазы, так как в системе отсутствует свободный кремнезем.
Последовательность процессов силикатообразования в подобных системах из аморфных кремнезема и гидроокиси алюминия практически не отличается от последовательности процессов формирования структурообразующих элементов на основе глин [13]. Однако кристаллизация новообразований протекает более медленно.
По данным Р. С. Жуковой [65], подобный вещественный состав новообразований отмечен при взаимодействии минералов глин с гидроокисью калия, который в зависимости от природы глинистого минерала и условий обработки изменяется в пределах K2O·Al2O3·(2—4)SiO2·nH2O; при нагревании кристаллизуется вещество состава K2O·Al2O3·2SiO2, а затем — ортоклаза K2O·Al2O3·6SiO2.
По данным Р. Ф. Руновой [29, 30], продуктами гидратации стекловидных щелочных алюмосиликатов едкими щелочами также являются водные щелочные алюмосиликаты типа природных цеолитов, которые при термической обработке стадийно переходят в безводные щелочные алюмосиликаты типа полевошпатных минералов.
Так, рентгеновские исследования стекловидного мариуполита, гидратированного 10%-ным раствором NaOH (рис. 13), показали, что в условиях пропаривания наблюдается образование кристаллической фазы, по межплоскостным расстояниям (d = 3,98; 3,40; 3,15; 2,89 Å) относящейся к высококремнеземистому цеолиту типа Na2O·Al2O3·10SiO2·nH2O, из которого через три месяца хранения образцов в естественных условиях выделился кремнезем и новообразования, представленные фазой анальцима (d = 4,92; 3,70; 3,45 Å), цеолита типа гидрат-нефелина-I (d = 2,95; 2,84; 2,54; 2,45 Å) и гидрат-нефелина-II (d = 2,74; 2,24; 1,91; 1,87; 1,75 Å). Эти же новообразования кристаллизуются в исследуемой системе сразу после автоклавной обработки.
При нагревании до 700°С возникшие гидраты аморфизуются, а при повышении температуры до 800—900°С образуются щелочные алюмосиликаты типа альбита (d = 3,74; 3,21; 2,92 Å). Подобный процесс имеет место и при взаимодействии калиевого полевого шпата — ортоклаза с едкой щелочью.
Поэтому можно заключить, что явления, сопровождающие формирование структуры искусственного камня на основе веществ щелочного и щелочно-щелочноземельного алюмосиликатного состава и едких щелочей, в том числе и шлакощелочных цементов, подобны синтезу и распаду природных минеральных образований аналогичного состава и представляют собой единый стадийный процесс силикатообразования, который непрерывно развивается во времени по мере повышения температуры (давления). Его можно разделить на четыре основных этапа: 1-й — гидратация алюмокремниевых веществ щелочами и синтез водных щелочных алюмосиликатов и щелочноземельных силикатов; 2-й — дегидратация и перекристаллизация вещества с образованием безводных щелочных и щелочноземельных систем, которые по составу близки к исходным водным системам или содержат меньше, чем в исходных, кремниевой кислоты; 3-й — насыщение новообразований кремниевой кислотой и их перекристаллизация в предельно насыщенные кремнеземом минеральные вещества; 4-й — плавление системы [13].
На основе сырья одного и того же состава, применяя различные виды обработки или условия эксплуатации, можно получить комплекс материалов, в которых структурообразующими связками будут служить низкоосновные кальциевые силикаты и щелочныеалюмосиликаты.
В шлакощелочных вяжущих системах, уже нашедших применение в строительстве, содержание окиси кальция колеблется в пределах 30—50%, а алюминия 5—15%. Поэтому активность вяжущих этой группы определяется, в основном, низкоосновными гидросиликатами кальция и щелочными гидроалюмосиликатами. Последние возникают также в результате гидратации едкими щелочами присутствующих в системе в виде добавок или заполнителей щелочных алюмосиликатов и минералов глин и улучшают показатели физико-механических свойств бетонов, в том числе и термостойкость. Этот вывод обосновывается тем, что в продуктах гидратации минеральных систем гидратационного твердения, каковыми являются едкая щелочь и глинистые минералы или едкая щелочь и щелочные алюмосиликаты типа R2O·Al2O3·(2—6)SiO2, формируются те же новообразования, которые возникают при гидратации алюмосиликатной составляющей шлакощелочных цементов.
Физико-химические процессы твердения портландцемента.
Одним из основных свойств цемента является прочность, которая определяется в положенные сроки испытанием образцовбалочек размером 40x40x160 мм первоначально на изгиб, а затем половинок — на сжатие. Балочки готовят из раствора состава 1:3 (1 ч. по массе цемента, 3 ч.— нормального Вольского песка) при водоцементном отношении (отношении количества воды к количеству цемента), равном 0,4. Водоцементное отношение в свою очередь проверяется, а при необходимости корректируется по расплаву конуса на встряхивающем столике. Расплыв усеченного конуса из растворной смеси, изготовленного в форме высотой 60 мм и основаниями верхним с внутренним диаметром 70 мм и нижним —100 мм, после 30 встряхиваний должен быть в пределах 106. 115 мм. При отсутствии встряхивающего столика испытанна проводят на стандартной лабораторной виброплощадке. В этом случае после 20 с вибрирования расплыв должен быть (170 ± 5) км.
Твердение цемента. Твердение портландцемента — сложный физикохимический процесс При затворении цемента водой основные минералы, растворяясь, гидратируются по уравнениям:
ЗСаО • S1O2 + 5Н2О = 2СаО • SiO2 • 4Н2О + Са(ОН)2;
2СаО • SiO2 + 4Н2О 2СаО • SiO2 • 4Н2О;
ЗСаО • А12Оз + 6ЩО = ЗСаО • AI2O3 • 6Н2О;
4СаО • А12Оз • Fe2O3 + Н2О = 4СаО • А12О3 • Fe2O3 • Н2О
Образующиеся новообразования отличаются от первоначальных меньшей растворимостью и, выпадая в осадок, выкристаллизовываются, что приводит к потере пластичности (схватыванию) и последующему твердению. Добавка гипса в самом начале процесса при растворении взаимодействует с трехкальциевым алюминатом, образуя гидросульфоалюминаты, которые, обволакивая цементные зерна, замедляют процесс растворения и гидратации. Однако в последующем эти оболочки разрушаются (чем меньше гипса, тем замедление короче по времени) и процесс твердения ускоряется. Но сами выкристаллизовывающиеся новообразования начинают препятствовать гидратации, поэтому значительная часть зерен цемента может гидратироваться при наличии водной среды весьма продолжительный срок, измеряемый даже годами.
Цемент твердеет тем быстрее, чем больше в нем алита (алитовые цементы) и трехкальциевого алюмината. С течением времени процесс твердения резко замедляется. Цементы, содержащие много белита (белитовые цементы), в раннем возрасте твердеют медленно; нарастание прочности продолжается длительно и равномерно. Процессы твердения и особенно схватывания сопровождаются выделением теплоты, которая тем интенсивнее, чем быстрее протекает процесс схватывания. Поэтому в массивных конструкциях, как правило, применяют белитовые цементы. Использование в таких конструкциях алитовых цементов может привести к интенсивности тепловыделению, разогреву до высокой температуры (70. 80 °С), появлению трещин и даже потере воды, что в итоге приведет к утрате цементным камнем своих качеств. В то же время применение алитовых цементов позволяет быстрее получить минимальную прочность, а интенсивное тепловыделение обеспечивает в некоторых случаях необходимую для твердения температуру в зимних условиях.
При твердении цемента на воздухе происходит небольшая усадка, а в воде — набухание.
При смешивании портландцемента с водой образуется пластичное, легко формуемое клейкое тесто, постепенно густеющее и переходяти камневидное состояние.
Твердение цемента—сложный процесс, включающий ряд химических и физических явлений. При затворении минералы цемента реагируют и дают различные новообразования.
В присутствии гипса и воды трехкальциевый алюминат образует эттрингит — гидросульфоалюминат кальция, замедляющий схватывание и твердение цемента.
Механизм твердения цемента очень сложен. Химические реакции начинают протекать сразу после смешивания цемента с водой. Частицы портландцемента начинают растворяться, одновременно с этим совершаются гидратация и гидролиз продуктов растворения.
Первыми гидратными новообразованиями являются эттрингит и гидроксид кальция.
Компоненты цемента растворяются слабо, медленно, образуется насыщенный раствор, заполняющий пространства между зернами. Затем образуются очень мелкие гидросиликаты, гидроалюминаты и гидроферриты кальция, практически нерастворимые в воде. Раствор становится перенасыщенным, быстро переходящий в коллоидное состояние. В виде мельчайших частиц из него выпадают гидратные соединения, образуется гель, обладающий клеящими свойствами.
В процессе дальнейшей гидратации в цементном тесте уменьшается количество свободной воды, клейкость геля увеличивается. Тесто густеет, происходит его схватывание. Затем новообразования начинают кристаллизоваться.
Образующиеся кристаллы сращиваются между собой, обрастают длинными игольчатыми кристаллами, в результате чего создается кристаллический сросток, т. е. наступает конец схватывания цемента. В дальнейшем цементный камень уплотняется за счет продолжающихся реакций взаимодействия между цементом и водой, частичного обезвоживания и дальнейшей кристаллизации.
При твердении цемента на воздухе цементный камень дополнительно упрочняется в результате карбонизации гидроксида кальция.
Затвердевший цементный камень представляет собой весьма прочный кристаллический каркас, заполненный гелем, внутри которого находятся не затронутые реакцией внутренние слои цементных зерен. Поры в цементном камне заполнены воздухом и капиллярной водой.
Из-за малой растворимости компонентов процесс твердения портландцемента протекает длительное время — годами. Однако нарастание прочности цемента с течением времени замедляется. Поэтому качество цемента принято оценивать по его прочности, набираемой через 28 сут твердения.
Схватывание и твердение портландцемента зависят от ряда факторов: химического и минерального состава клинкера, содержания добавок, тонкости помола, температуры и влажности окружающей среды и пр. Понижение температуры от 20° до 5 °С замедляет твердение цемента почти в три раза; повышение температуры до 80 °С ускоряет гидратацию в шесть раз.
Цемент нормально твердеет лишь при достаточной влажности среды; повышение температуры не должно сопровождаться высушиванием. Ускорение процессов твердения портландцемента при тсплопой обработке — запаривании, пропаривании, электропрогреве — позволяет получать в короткий срок бетонные и железобетонные изделия требуемой отпускной прочности.
№ 35 (Анастасия Заболотская)
Химическая коррозия цементного камня.(Тема вашего вопроса)
Бетонные и железобетонные конструкции должны характеризоваться не только механической прочностью и устойчивостью под действием рабочих нагрузок, но и надлежащей долговечностью (стойкостью) под разрушающим (агрессивным) влиянием разнообразных внешних химических и физических факторов.
В зданиях и сооружениях бетоны могут подвергаться отрицательному воздействию, в первую очередь, воды и водных растворов различных веществ, в том числе и газов, вызывающих химическую коррозию; различных неорганических и органических веществ в жидком и газообразном состоянии (химическая коррозия); многократно повторяющихся процессов увлажнения и высыхания, а также замерзания и оттаивания, часто в водонасыщенном состоянии (физическая коррозия); различных веществ, отлагающихся в порах и капиллярах цементного камня и бетона в результате капиллярного подсоса минерализованных вод и их испарения; кристаллизуясь, они могут вызывать вредные напряжения (физическая коррозия).
Следует подчеркнуть, что разрушающее влияние на бетон различных агрессивных факторов часто усиливается его напряженным состоянием, возникающим под действием механических нагрузок.
Портландцемент и различные его производные, а следовательно, и бетоны на их основе характеризуются относительно высокой стойкостью против действия многих агрессивных факторов, наиболее часто встречающихся при эксплуатации зданий и сооружений. Тем не менее при неблагоприятных условиях они могут быстро разрушаться, и необходимы мероприятия, защищающие бетонные и железобетонные конструкции от преждевременного износа.
Различные виды цементов характеризуются различной стойкостью против действия тех или иных агрессивных факторов. Например, цементы с низким содержанием алюминатов кальция характеризуются повышенной стойкостью против действия гипса и других сульфатов и называются поэтому сульфатостойкими. Пуццолановые портландцементы отличаются повышенной водостойкостью и т.д. Поэтому выбирать цементы для бетонов различного назначения следует с учетом не только их прочностных показателей, но и стойкости против действия тех агрессивных сред, в которых должны работать бетонные конструкции.
В этой главе рассматриваются вопросы, связанные преимущественно с воздействием на цементы и бетоны мягких и минерализованных вод.
Проблема долговечности цементов и бетонов еще с конца XIX в. изучалась отечественными учеными, установившими причины и факторы коррозии и предложившими эффективные меры по увеличению стойкости (А. Р. Шуляченко, В. И. Чарномским, А. А. Байковым, В. А. Киндом, В. Н. Юигом и др.).
В. М. Москвин разделяет коррозионные процессы, возникающие в цементных бетонах при действии водной среды, по основным признакам на три группы. К первой группе (коррозия I вида) он относит процессы, протекающие в бетоне под действием вод с малой временной жесткостью. При этом некоторые составляющие цементного камня растворяются в воде и уносятся при ее фильтрации сквозь толщу бетона.
Ко второй группе (коррозия II вида) относятся процессы, развивающиеся в бетоне под действием вод, содержащих вещества, вступающие в химические реакции с цементным камнем. Образующиеся при этом продукты реакций либо легкорастворимы и уносятся водой, либо выделяются на месте реакции в виде аморфных масс, не обладающих вяжущими свойствами. К этой группе могут быть отнесены, например, процессы коррозии, связанные с воздействием на бетон различных кислот, магнезиальных и других солей.
В третьей группе (коррозия III вида) объединены процессы коррозии, вызванные обменными реакциями с составляющими цементного камня, дающими продукты, которые, кристаллизуясь в порах и капиллярах, разрушают его. К этому же виду относятся процессы коррозии, обусловленные отложением в порах камня солей, выделяющихся из испаряющихся растворов, насыщающих бетой.
Обычно на бетонные конструкции одновременно воздействуют многие агрессивные факторы, но один из них обычно является основным. Чаще всего это процессы, вызывающие коррозию II вида.
В. В. Кинд дает более подробную классификацию основных видов коррозии бетона под действием природных вод:
1) коррозия выщелачивания, вызываемая растворением гидроксида кальция, содержащегося в цементном камне, и выносом его из бетона;
2) кислотная коррозия — результат действия кислот при значениях показателя рН менее 7;
3) углекислотная коррозия, обусловленная действием на цементный камень углекислоты и являющаяся частным случаем кислотной коррозии;
4) сульфатная коррозия, подразделяемая на суль-фоалюмииатиую, вызываемую действием на цемент ионов SCXf при их концентрации от 250—300 до 1000 мг/л; сульфоалюминатно-пшсовую, также возникающую главным образом под действием сульфатных ионов SO-f» но. при концентрации их в растворе более 1000 мг/л, и гипсовую, которая происходит под действием воды, содержащей большое количество Na2S04 или KaSO4;
5) магнезиальная коррозия, подразделяемая на собственно магнезиальную, вызываемую действием катионов магния при отсутствии в воде ионов S04 и сульфатно-магнезиальную, происходящую в цементном камне при совместном действии на него ионов Mg2+ и SO4.
Все эти виды коррозии возможны в результате действия не только природных, но и промышленных и бытовых сточных вод. Кроме приведенных видов коррозии может иметь значение и кислотно-гипсовая коррозия под действием серной кислоты, а также сероводородная коррозия, имеющая свои особенности.
В условиях службы в промышленных, сельскохозяйственных и других зданиях и сооружениях бетоны могут подвергаться и другим разнообразным видам коррозии (действию щелочей и других веществ, животных жиров, растительных масел, углеводов, спиртов, фенолов и т.п.), что надо учитывать при использовании бетонов в конструкциях и защите их от повреждений.
В СНиП П-28-73 «Защита строительных конструкций от коррозии» установлены показатели степени агрессивности воды-среды с учетом содержания в ней бикарбонатов, а также плотности бетона и условий эксплуатации сооружений (фильтруемость грунтов, напор воды). Так, для бетонов «нормальной» плотности, изготовленных при В/Ц==0,6 и характеризующихся маркой по водонепроницаемости В-4, в условиях сильиофильтрующих грунтов вода-среда становится слабоагрессивной при би-карбонатной щелочности в пределах 1,4—0,7 мг«экв/л (или 4—2°). Увеличение ее содержания или плотности бетона уменьшает опасность коррозии 1-го вида.
Присутствие в водном растворе NaCl и Na2S04 повышает растворимость Са(ОН)2 в воде, который следовательно, быстрее вымывается из бетона.
Кислотная коррозия возникает под действием различных неорганических и органических кислот, вступающих в химическое взаимодействие с гидроксидом кальция, а также с другими соединениями цементного камня. Этот вид коррозии в зависимости от силы той или иной кислоты, определяемой показателями концентрации ионов водорода рН, может протекать очень интенсивно. Следует помнить, что цемент характеризуется высокой химической основностью составляющих и, следовательно, способен энергично взаимодействовать не только с кислотами, но и с такими солями, как А12(804), (NH4)2S04, FeCl3 и др., гидролизующимися с образованием сильных кислот.
Под действием той или иной кислоты на цементный камень образуются кальциевая соль и аморфные бессвязные массы §i02-aq, А1(ОН)з, Fe(OH)3. Для примера можно привести схему действия соляной кислоты на C3S2H3—основной гидросиликат цементного камня: 3CaO-2Si02-3H20 + mHCl-^3CaCl2 + 2Si02-a
Дата добавления: 2015-04-18 ; просмотров: 16 ; Нарушение авторских прав
Схватывание и твердение бетона или цемента.

Многие знают, что цемент при взаимодействии с водой твердеет и превращается в так называемый цементный камень. Однако, немногие знают суть этого процесса: как твердеет, почему твердеет, что нам даёт осознание происходящей реакции и каким образом мы можем на неё воздействовать. На сегодняшний момент понимание всех стадий гидратации позволяет учёным изобретать новые добавки в бетон или цемент, так или иначе воздействующие на процессы, происходящие в период схватывания цемента и твердения бетонной или ЖБИ конструкции.
Заводы выпускающие ЖБИ или товарный бетон могут пользоваться этими добавками с огромной пользой для себя. Это и экономия электроэнергии и газа за счёт сокращения сроков пропаривания ЖБИ изделий, и снижение трудозатрат на вибрирование, и скорость оборачивания формоснастки или опалубки, и экономия цемента, и улучшение качественных характеристик товарного бетона и изделий ЖБИ. Всё это возможно за счёт применения специальных добавок для бетона или цемента. Перечень используемых на сегодняшний день добавок довольно велик, поэтому ему посвящён отдельный раздел добавки в бетон.
Вообще, в процессе набора прочности бетона присутствуют две основные стадии:
- схватывание бетона довольно короткая стадия, происходящая в первые сутки жизни бетона. Время схватывания бетона или цементного раствора существенно зависит от температуры окружающего воздуха. При классической расчётной температуре 20 градусов начало схватывания цемента происходит примерно через 2 часа после затворения цементного раствора, а конец схватывания наступает примерно через три часа. То есть — процесс схватывания занимает всего 1 час. Однако, при температуре 0 градусов этот период растягивается до 15-20 часов. Чего говорить, если само начало схватывания цемента при 0 градусов начинается лишь спустя 6-10 часов после затворения бетонной смеси. При высоких температурах, например при пропаривании ЖБИ в специальных камерах мы ускоряем период схватывания бетона до 10-20 минут!
В течение периода схватывания бетон или цементный раствор остаются подвижными, на них ещё можно воздействовать. Тут действует механизм тиксотропии. Пока Вы «шевелите» несхватившийся до конца бетон, он не переходит в стадию твердения, и процесс схватывания цемента растягивается. Именно поэтому доставка бетона на бетоносмесителях, сопровождающаяся постоянным перемешиванием бетонной смеси, способна сохранить её основные свойства. При желании прочтите подробности про основные свойства и состав бетона.
Из личного опыта могу вспомнить экстраординарные случаи, когда наши миксера с бетоном стояли и «молотили» на объекте по 10-12 часов, в ожидании разгрузки. Бетон в такой ситуации не твердеет, но происходят некие необратимые процессы, существенно снижающие его качества в дальнейшем. Мы называем это свариванием бетона. Особенно критичны такие мероприятия летом в жару. Вспомните сокращённые сроки схватывания цемента при высокой температуре, о которых мы говорили выше. Менеджеры и диспетчера Компании BESTO стараются избегать подобных казусов, но иногда происходят непредвиденные ситуации, в основном связанные с обрушением некачественной опалубки. Бетон разливается, все бегают, пытаясь его собрать, восстанавливают опалубку, а время идёт, а ещё не разгрузившиеся бетоносмесители с бетоном стоят и молотят. Хорошо, если есть куда переадресовать, а если нет? Одним словом — беда.
Минералогический состав и гидратация цемента
Мы не будем здесь разбирать сами стадии получения портландцемента, для этого есть специальный раздел, описывающий производство цемента более подробно. Нас интересует лишь состав цемента и его основные компоненты, вступающие в реакцию с водой при затворении цементного раствора или бетона. Итак. В качестве основы портландцемента рассматриваются четыре минерала, полученные в результате всех стадий производства цемента:
- C3S трёхкальциевый силикат
- C2S двухкальциевый силикат
- C3A трёхкальциевый алюминат
- C4AF четырёхкальциевый алюмоферит
Поведение каждого из них на разных стадиях схватывания бетона и его твердения, существенно отличается. Одни минералы вступают в реакцию с водой затворения сразу, другие немного погодя, а третьи — вообще не понятно зачем здесь «ошиваются». Давайте рассмотрим всех по порядку:
C3S трёхкальциевый силикат 3CaO x SiO2 минерал участвующий в процессе нарастания прочности цемента в течение всего времени. Без сомнения, он является главным звеном, хотя, в период первых суток жизни бетона у трёхкальциевого силиката есть серьёзный более шустрый соперник C3A, о котором мы упомянем позже. Процесс гидратации цемента является изотермическим, то есть — химическая реакция сопровождающаяся выделением тепла. Именно C3S «греет» раствор цемента при затворении, прекращает греть в период с начала затворения до момента начала схватывания, затем выброс тепла в течение всего периода схватывания и дальше происходит постепенное снижение температуры.
Трёхкальциевый силикат и его вклад в набор прочности бетона наиболее значим лишь в первый месяц жизни бетонной или ЖБИ конструкции. Это те самые 28 дней нормального твердения. Далее, его влияние на набор прочности цемента ощутимо уменьшается.
C2S двухкальциевый силикат 2CaO x Si02 начинает активно действовать лишь спустя месяц после затворения цемента в бетонной смеси, как будто принимая смену у своего трехкальциевого брата-силиката. В течение первого месяца жизни бетона или ЖБИ он в общем-то валяет дурака и ждёт своего часа. Это период безделья и расслабухи можно существенно сократить за счёт применения специальных добавок в цемент. Зато, его действие длится годами, в течении всего периода нарастания прочности железобетона, ЖБИ или бетона.
C3A трёхкальциевый алюминат 3CaO x Al2O3 наиболее активный из перечисленных. Он начинает кипучую деятельность с самого начала процесса схватывания. Именно ему мы обязаны за набор прочности, в течение первых дней жизни бетона или железобетона. В дальнейшем его роль в твердении и наборе прочности минимальна, но в скорости ему нет равных. Марафонцем его не назовёшь, а вот спринтером, пожалуй — да.
C4AF четрыёхкальциевый алюмоферит 4CaO x Al2O3 x Fe2O3 это как раз тот самый, который — «непонятно зачем вообще здесь ошивается». Его роль в наборе прочности и твердении минимальна. Незначительное воздействие на набор прочности отмечается лишь на самых поздних сроках твердения.
Все перечисленные компоненты при затворении водой вступают в химическую реакцию, благодаря которой происходит нарастание, сцепление и осаждение кристаллов гидратированных соединений. По сути, гидратацию можно назвать и кристаллизацией. Так наверное понятней.
Благодаря стараниям учёных и научным разработкам многочисленных испытательных лабораторий и НИИ стало возможным прогнозируемое и регулируемое воздействие на процесс гидратации цемента, влияние на начало и конец схватывания, регулируемая подвижность бетона, его прочность, коррозионная стойкость и так далее. В основном это делается за счёт применения специальных добавок в бетон. Спектр доступных методов воздействия на процесс схватывания цемента и дальнейшего набора прочности бетона или ЖБИ довольно широк и более подробно он описан в разделе добавки для бетона.
Компания БЭСТО поставляет товарный бетон и раствор, изготовленные с применением самых современных добавок, позволяющих получать бетонные смеси и цементные растворы с улучшенными показателями по морозостойкости, водонепроницаемости, подвижности и т.д. Современное дозирующее и бетоносмесительное оборудование помогает добиться наилучших результатов по однородности состава бетонной смеси или цементного раствора.
Надеюсь, что не загидратировал Вам мозги своими силикатами и алюминатами. С трёхкальциевым приветом, Эдуард Минаев.
6. Твердение портландцемента
При смешении цемента с водой на начальных стадиях твердения в реакцию гидратации интенсивно вступают алюминаты и алюмоферриты кальция,
благодаря более высокой константе скорости растворения по сравнению с алитом к белитом. Раствор становится пересыщенным по отношению к конечному продукту и из него на поверхности зерен клинкера и в объеме раствора образуются иглообразные кристаллы гидроалюминатов и гидроферритов кальция различного состава. В общем, виде их состав можно обозначить x CaO y AI 2 O 3 m —
Н 2 О и x СаО y Fe 2 O 3 m Н 2 O. Значения коэффициентов x, y, m изменяются в различных соотношениях и зависят, главным образом, от термодинамических условий процессов гидратации.
Через некоторое время (3-6 часов) в системе накапливается достаточно много кристаллогидратов и образуются «стесненные» условия, приводящие к образованию коагуляционной структуры, которая по мере накапливания гидроалюминатов переходит в кристаллизационную. Через 6 — 10 часов весь объем между постепенно уменьшающимися зернами цемента заполняется скелетом иглообразных кристаллов — продуктов гидратации алюминатных составляющих клинкера. Эта структура иногда называется алюминатной Цементный раствор, бывший до этого пластичным, начинает терять подвижность
И набирать прочность.
В оставшемся объеме одновременно с алюминатной, но со значительно меньшей скорость, возникают продукты гидратации силикатных клинкерных минералов алита т белита, называемые гидросиликатами кальция
Последние образуют чрезвычайно тонкопористый ворс из очень малых кристаллов, так называемую силикатную структуру. Влияние этой структуры на прочность твердеющего цементного камня со временем все более увеличивается.
Она уже является собственно носителем прочности цементного камня и
приблизительно через 1 сутки начинает преобладать над алюминатной. К

Овчинников В. П. Тампонажные материалы. Конспект лекций
месячному сроку в цементном камне обнаруживается практически только силикатная структура. К этому времени процесс гидратации не заканчивается и в ряде случаев может продолжаться годами за счет неиспользованного клинкерного фонда цемента.
Процесс формирования цементного камня является сложным и многообразным. Чтобы получить более полное представление о взаимодействии портландцемента с ЕОДОЙ целесообразно рассмотреть реакции взаимодействия отдельных клинкерных компонентов.
7. Гидратация цементов как химический процесс. Фазовый состав продукции твердения
При гидратации алита протекает реакция, которая в общем виде может быть записана следующим образом:
3 CаO SiO 2 + (3 x) H 2 O = (З x) Ca(OH) 2 + x СаО y SiO 2 O m H 2 O.
Значения коэффициентов x, y, m меняются в зависимости от внешних условий протекании реакций гидратации, главным образом от температуры.
Гидратация белита протекает по аналогичной схеме с образованием гидросиликатов того же состава:
2 CаO SiO 2 + (2 + x) H 2 O = (2 x) Ca(OH) 2 + x СаО y SiO 2 O m H 2 O.
При нормальной температуре продуктом гидратации алита и белита является один и тот же гидросиликат, обозначаемый СН(П) или С 2 SН 2 . Кроме гидросиликата в достаточно большом количестве образуется кристаллический Са(OН) 2 , причем при гидратации алита его образуется значительно больше, чем при гидратации белита. При повышении температуры до 100-110°С образуется тот же гидросиликат СSН(П), но с более высоким содержанием оксида кальция.
При 70-80°С основность (отношение числа молей CaO к SiO 2 ) гидросиликатов достигает предельного значения, равного 2. Гидросиликат CSH(П) — первая гидросиликатная фаза, образующаяся при более высоких температурах. Затем он превращается в гидросиликат, обозначенный C 2 SH(А), или — гидрат C 2 S.
Температурный интервал устойчивости этого гидросиликата — I25 -175°С. При более высоких температурах он переходит в Г идросиликат C 2 SH(С) ( — гидрат С 2 ).

Овчинников В. П. Тампонажные материалы. Конспект лекций
При температурах, выше 160°C может образовываться гидросиликат C 3 SH 2 . При температурах выше 125°С также образуется гидросиликат С 2 SН(B), называемый гиллебрандитом. Размеры гидросиликатов, образующихся при повышенных температурах, более крупные, чем размеры кристаллов, образующихся при низких температурах.
Таким образом, при гидратации силикатных клинкерных минералов образуется, главным образом, высокоосновные гидросиликаты кальция, имеющие мольное отношение Cao/SiO 2 более 1,5. Однако эти гидросиликаты обладают большей растворимостью и высокой константой скорости растворения, поэтому в плане обеспечения долговечности крепи скважины они не являются оптимальными.
При повышенных температурах растворимость кремнеземистых компонентов возрастает, и растворенный SiO 2 связывает гидрооксид кальция с образованием, гидросиликатов пониженной основности. Уменьшение содержания свободного гидрооксида кальция в растворе также способствует снижению основности. Уменьшение содержания свободного гидрооксида кальция в растворе также способствует снижению основности продуктов твердения и повышению их долговечности и прочности. Поэтому для крепления интервалов с высокими температурами требуется введение в состав тампонажных портландцементов кремнеземсодержащих материалов, шлаков, золы, молотого песка и т.д.
Согласно схемы, предложенной Я. Скальни и Дж. Янгом, механизм гидратации трехкальциевого силиката представляется следующим образом: C 2 S
реагируют c dодой сразу же при контактировании. Во время: индукционного периода происходит обмен ионов между раствором и твердым непрогидратированным веществом, способствуя автокаталитическому увеличению скорости реакции. При этом большое количество продуктов гидратации с низкой плотностью и увеличенным объемом по сравнению с негидратированной фазой осаждается на покрытую водой поверхность минерала.
Это обусловливает общее увеличение пористости, системы, что, в свою очередь,
снижает перенос ионов на поверхность раздела между твердым веществом и

Овчинников В. П. Тампонажные материалы. Конспект лекций
жидкостью, замедляя процесс гидратации. Этот период рассматривается как контролируемая диффузией стадия гидратации.
Что такое гидратация цемента?

Необратимый процесс, во время которого бетон теряет свою подвижность, именуют гидратация цемента. Это весьма важный, определяемый нормативами показатель. Он выявляет качество материала.
Гидратация цемента — что это такое
Этим термином обозначают физико-химический процесс, при котором происходит связывание компонентов цементного порошка с жидкостью. Чтобы разобраться в особенностях этого действия, нужно скрупулезно исследовать состав цемента. Только тогда получится понять, как взаимодействуют ингредиенты порошка с водой, что влияет на период схватывания цемента, изучить остальные характеристики стройматериала. В его состав включены активные добавки минеральной природы, благодаря которым бетон медленно набирает требуемый уровень своей прочности. Какой бы марки и типа не был цемент, он содержит в себе четыре минеральных вещества:
- двухкальцивеый силикат;
- трехкальциевый силикат;
- трехкальциевый алюминат;
- четырехкальциевый алюмоферит.
 Рисунок 1. Химический состав бетона
Рисунок 1. Химический состав бетона
Влияние компонентов на гидратацию
Каждый из таких компонентов чрезвычайно важен, все они обладают специфическими характеристиками, помогающими влиять сначала на схватывание, а затем и твердение цемента. Одни начинают незамедлительно взаимодействовать с влагой, иные действуют постепенно, спустя определенное время. Рассмотрим, как на гидратацию влияет каждый ингредиент:
- Двухкальциевый силикат вступает в работу только спустя месяц после момента затвердения бетона. До этого он не участвует в процессе, ожидая своей очереди. Наличие специальных пластификаторов, присутствующих в бетонной смеси, помогает значительно сократить период бездействия без риска ухудшения прочности материала. Этот ингредиент функционируют в долгосрочной перспективе, позволяя укреплять со временем монолит бетонной заливки.
- Трехкальциевый силикат функционирует активно весь период существования цемента. Это вещество — основа смеси, именно оно запускает процесс, именуемый гидратацией. Когда он стартует, выделяется тепло, которое существенно повышает температуру смеси.
- Трехкальциевый алюминат обеспечивает процесс схватывания, поскольку он наиболее активный компонент. Это вещество обеспечивает неуклонное нарастание прочности монолита в самые первые несколько дней после заливки. Потом ингредиент работу прекращает.
- Четырехкальциевый алюмоферит, хотя и оказывает минимальное воздействие на твердение и набор прочности монолита, все равно чрезвычайно важен. Его работа стартует на финишном этапе, когда уже давно запущена процедура затвердевания цемента. Этот компонент улучшает достигнутые характеристики, тем самым завершая процесс.
Каждый перечисленный минеральный компонент определяет качество цемента, обеспечивает правильное течение процесса гидратации. Когда порошок смешивают с водой, внутри раствора немедленно появляются внутрикристаллические связи, которые определяют медленно нарастающую прочность, благодаря которой бетон в итоге приобретает состояние, схожее по параметрам с искусственным камнем.
Особенности гидратации
Из-за того, что период схватывания цемента быстротечен (45–90 минут), смесь требуется готовить незадолго до использования, оставляя время для выполнения заливки до финиша реакции, когда обрабатывать смесь уже невозможно либо бесполезно. Чтобы реакция гидратации полноценно произошла, пропорции объемов цемента с жидкостью должны соответствовать значению 3:2. Только четверть молекул воды химически связывают с порошком, остальные сохраняются в бетонных порах, имея связанный физически вид.
При уменьшении количества воды гидратация произойдет не полностью, в случае повышения ее объема — к развитию капиллярных пор внутри монолита, которые снизят его прочность. Инструкции к каждой конкретной марке цемента либо бетона всегда информируют о точных требуемых объемах составляющих.
Состав цемента и его гидратация
Как ранее уже было указано, на твердение портландцемента влияют четыре минеральных ингредиента, полученные при производстве этого связующего продукта. Поведение каждой составляющей значительно отличается и зависит о стадии схватывания монолита. Одни компоненты реагируют на появление воды немедленно, иные дожидаются своей очереди, а некоторые вообще вроде бы не участвуют в процессе.
Но все они при взаимодействии с водой начинают химическую реакцию, обеспечивающую нарастание, затем сцепление, а в итоге осаждение кристаллов насыщенных влагой соединений. Если рассматривать мероприятие с точки зрения химика, то оно является кристаллизацией.
Основные стадии затвердевания
Непосредственно процесс затвердевания монолита делится на два этапа. Сначала раствор схватывается, а затем твердеет. Первая стадия длится примерно сутки после приготовления смеси. На ее скорость влияет в основном только температура окружающего воздуха:
- Когда термометр показывает около 20° тепла, бетон схватится примерно через пару часов после замешивания. Окончательное же схватывание гарантировано через 3 часа. То есть, этап схватывания длится примерно час.
- Если температура воздуха 0°, такой процесс происходит дольше, может длиться даже 20 часов. Это связано с оттягиванием времени начала схватывания — процесс стартует только спустя 6–10 часов.
 Рисунок 2. Бетон
Рисунок 2. Бетон
Одновременно фактором влияния, определяющим скорость схватывания, становятся специфические добавки. Они способны ускорять или замедлять химическую реакцию.
Все время, пока длится этап схватывания, бетон сохраняет подвижность. Он подвержен любым механическим воздействиям. При осуществлении любых мероприятий относительно еще не успевшего схватиться монолита, нужно понимать, что они удлиняют срок его первоначального схватывания.
Финальный этап получения качественного монолита — твердение раствора. Оно происходит незамедлительно после завершения предыдущей фазы. Сам такой процесс чрезвычайно медленный, нередко он тянет несколько лет. В самые первые дни твердения монолит еще динамичен, отличается нелинейностью состояния.
Заключение
Гидратацию цемента нужно понимать, чтобы обеспечивать технологию выпуска качественного бетона. Приступая к созданию цементного раствора, требуется правильно составлять водо-цементную пропорцию, точно отмерять иные компоненты бетона, действовать строго по инструкции. Это гарантирует раствору создание идеальных условий, чтобы все реакции в нем проходили по правилам.
Химические реакции при твердении цементов
При твердении цемента происходят реакции гидратации, гидролиза и обменного взаимодействия, протекающие при затворении цемента водой в жидкой фазе или па поверхности твердых частиц цемента. Большинство реакций сопровождается выделением тепла. Продукты реакции — твердые вещества либо квазитвердые, частично растворимы в воде и образуются в условиях постоянного уменьшения массы воды в процессе твердения.
Изучение химических реакций, протекающих при взаимодействии заводского цементного клинкера с водой, связано с большими трудностями. Клинкер состоит из минералов, в различной степени модифицированных твердыми растворами, застывшей жидкой фазы, стекла и т. п., и поэтому условия его твердения иные, чем у отдельных синтезированных в лабораторных условиях минералов. Кроме того, вода в процессе взаимодействия с цементом насыщается переходящими в раствор известью, гипсом и щелочами, наличие и концентрация которых в жидкой фазе твердеющего цемента существенно влияет на состав гидратных новообразований. При этом наблюдается взаимовлияние отдельных реакций, происходящих при твердении.
При гидратации индивидуальных синтетических минералов — силикатов кальция было установлено, что реакция C3S с водой приводит к образованию C3S2HX, на пограничной поверхности возникает пленка толщиной в несколько молекул. При комнатной температуре реакция C3S с водой стехиометрически описывается уравнением:
2(3 Ca0-Si02) +6н0о = 3Ca0-2Si0A-3H,0 + ЗСа(ОН)2.
При гидратации портландцемента в нормальных условиях образующиеся гидросиликаты кальция имеют переменный состав, в значительной степени близки к аморфным веществам и не образуют полной кристаллической структуры, которая возникает при твердении цемента в условиях повышенных температуры и давления. Они могут быть отнесены к полукристаллическим слабозакристаллизованным соединениям. К полукристаллическим слабозакристаллизованным относят также соединения, дающие на порошкограммах более трех линий, в которых отсутствует нормальный трехмерный порядок, характерный для кристаллических объектов.
Относительно хорошо образованные кристаллические гидросиликаты могут быть обозначены (по Тейлору): С —s — Н (I), если C/S = 0,8—1,5; С — S — Н (II), если C/S>1,5; в некоторых работах гидросиликаты С — S — Н (I) обозначаются С — S — Н (В), поскольку имеют тот же состав, но отличаются меньшей степенью закристаллизованности. Образующийся в цемент — Ном камне гидроксид кальция (СН) может быть отне-
Сен к веществам с полной кристаллической структурой, которую можно наблюдать в оптический микроскоп.
М. М. Сычев [138] рассматривает гидратацию клинкерных минералов как процесс, при котором происходит разрыв ионных связей между тетраэдрами Si04, мостиковыми ионами кальция и кислородом, в том числе разрыв более ковалентных связей Si — О в тетраэдрах. При этом связи Са—О—Si рвутся при про — тонизации, а связи Si — О — Si в результате комплек- сообразования с ОН — ионами и повышения координационного числа Si до 5—6 при более высоком значении рН.
Состав, структура и другие физико-химические характеристики гидросиликатов кальция (ГСК) изучались Н. В. Беловым, Е. Н. Беловой, В. В. Тимашевым, М. М. Сычевым, X. Ф. У. Тейлором, Г. J1. Калоусеком [8, 135, 137, 138, 140]. Исследованиями в этой области занимались также В. В. Илюхин, В. А. Кузнецов, А. Н. Jlo — бачев, В. С. Бакшутов [34]. ГСК различаются по основности (Ca0:Si02), содержанию воды, характеру кристаллизации и другим показателям. Некоторые гид — рос’иликаты кальция синтезированы при различных температурах при атмосферном и повышенном давлении, другие встречаются в природе. Гидросиликаты кальция относятся к волластонитовой — ксонотлитовой, тобер — моритовой, гиролитовой группам; выделена также группа высокоосновных ГСК-
X. Ф. У. Тейлор отмечает, что С — S — Н-фаза не подобна тобермориту, а является гелем с характерной слабой закристаллизованностью [140]. По представлениям М. М. Сычева, образование С — S — Н-фазы является результатом перестройки слоя минерала,, откуда выщелочен избыточный кальций и через который происходит диффузия ионов Са2+ и ОН
в сторону жидкости. Это положение теперь дополнено представлениями Тейлора о возможности существования промежуточного слоя под слоем новообразований и названного слоем Тейлора. Это гелеобразиый слой с низкой основностью, чем, видимо, объясняется наличие внешних и внутренних продуктов гидратации, различающихся по основности. В гелеподобном (квазитвердом) слое Тейлора выделяют зоны реакции растворения, гидро — ксилирования и растворения на границе раздела слоя Тейлора и водной среды. Состав и морфология фазы
С — S — Н, образующейся в пространстве, занятом вначале соответственно цементным зерном и водой, различны во внешних и внутренних частях зерна.
Как «внутренний» продукт, так и «внешний», содержащий больше Са2+, образуются вследствие хемо — сорбции ионов Са++ наружной или внутренней поверхностью слоя Тейлора. Количество «внешнего» С — S — Н крайне мало по сравнению с содержанием «внутреннего» С — S — Н. Показано, что в первые минуты гидратации происходит конгруэнтное растворение минералов и затем осаждение из раствора С — S — Н — фазы на поверхности алита. Полагают также, что С — S — Н-фаза содержит большое количество примесных атомов; благодаря своей аморфности и чрезвычайно развитой удельной поверхности она отличается высокой диссоциативностыо.
Поскольку жидкая фаза твердеющей системы (рис. 7) быстро и полно насыщается оксидом кальция, полагают, что вначале образуется гидросиликат кальция C2SH2, который по мере выделения извести в твердую фазу переходит в CSH(B) (рис. 8). Этому способствует также переход в раствор щелочей, снижающих в нем концентрацию извести. Гидратация |3-C2S в указанных выше условиях идет по приведенной выше схеме, но при меньшем выделении извести.
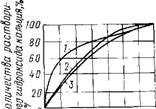
16 32 Hi И Время, сут
Рис. 7. Скорость растворимости извести при гидратации силикатов кальция
1— 3Ca0Si02; 2 — |5-2Ca0-Si02; 3 — V-Ca0-Si02
Под электронным микроскопом внешний слой С—S—Н-фазы имеет вид рыхлой фольги или весьма тонких волокон, порядка нескольких молекулярных слоев (рис. 9, 10). Удельная поверхность их довольно высока и в зависимости от степени слипания составляет примерно 250—350 м2/г. Можно заметить в этом сходство с некоторыми глинистыми минералами. Способность к обратимой отдаче воды указывает па то, что вода находится между слоями кристаллической решетки, плотность которой в зависимости от содержания воды может меняться. Считают, что это одна из важнейших Причин, от которых зависят многие строительно-тех-

Рис. 9. Электронная стереомикро — фотография реплики с поверхности скола камня C^S, гидратироваино- го 7 сут (по данным J] Шпыно — вой)

Рис. 10. Электронная стереомикро — фотография с поверхности камня Сз5, гидратированного 6 лет (по данным Л. Шпыновой)
Рис. 11. Электронная стереомикро — фэтография реплики с поверхности камня С А, гидратированного 6 мес (по данным Л. Шпыновой)
Нические свойства портландцемента и, в частности, ус’адка и набухание.
Гидратация Са3А с водой протекает с большой скоростью при значительном выделении тепла. Вначале при температуре до 25°С образуется C3AHU_12 в виде гексагональных пластинок. Однако считают, что это соединение является гетерогенной эквимолекулярной смесью С4АН12 и C2AHg.
Гидроалюминаты общего состава С4АНХ в зависимости от температуры и влажности среды могут иметь следующее содержание воды: С4АН19—С4АН13—С4АНИ— С4АН7. По мере повышения температуры гексагональные гидроалюминаты кальция оказываются неустойчивыми и постепенно превращаются в стабильные кубические кристаллы С3АН6. При затворении С3А ледяной водой и охлаждении твердеющей системы образуется С4АН13 и АН3. При температуре затворения 21°С реакция протекает по схеме:
3 СаО — А1203 — г 6 НгО = ЗСа0-А1208-6Н,0
С3АН6 является единственным устойчивым соединением из всех гидроалюминатов кальция. Другие гидроалюминаты кальция медленно при нормальной температуре и весьма быстро при повышенных температурах переходят в кубические кристаллы С3АН6 (рис. 11). Такая перекристаллизация влияет на структуру и соответственно на прочность цементного камня; при высоком содержании в нем гидроалюминатов кальция возможно значительнее снижение прочности.
При гидратации С3А в присутствии некоторых соединений не исключено появление комплексных новообразований:
3 СаО-AJ203-3 CaS04-3J Н20, 3 СаО ■ А1203 ■ CaS04 ■ 12 Н20, 3 СаО — AJ203-CaCJ2- (10 — 12) Н,0, ЗСа0-А1203-Са (N03)2-ЮН20, 3 СаО — А1203 (Са, Mg)C03- JIH20.
С4АН13 можно рассматривать также как ЗСаО — •А1203-Са(0Н)2 — 12Н20.
Гидратация алюмоферритов кальция исследована применительно к наиболее часто встречающемуся в клинкере C4AF; его гидратация также зависит от температуры среды и содержания в растворе извести. В условиях гидратации портландцемента, т. е. насыщенного известью раствора при нормальной температуре, взаимодействие его с водой стехиометрически описывается следующим уравнением:
4 CaO-Al203-Fe203 + 2 Са (ОН)2 + 10 Н20 =
В результате образуются весьма устойчивые смешанные кристаллы С3(А, F)H6. При низкой температуре, примерно около 0°С, в насыщенном известью растворе образуется С4(А, F) Н13, гексагональные кристаллы кото рого также постепенно переходят в С3(А, F)Hg. Важным свойством алюмоферритов кальция является способность образовывать при гидратации ряд твердых растворов между гидроферритами и гидроалюминатами кальция, что благоприятно влияет, в частности, на коррозиеустойчивость портландцемента.
Гидратация содержащихся в клинкере свободной извести, а также периклаза (несвязанной MgO) протекает медленно с образованием гидроксида кальция и бру-‘ сита — Mg(OH)2. При крупных кристаллах свободной извести или периклаза становится особо заметным увеличение объема этих гидратных новообразований, что может вызвать существенные напряжения в цементном камне, нарушающие его структуру. Допустимое содержание СаОсвоб в нормально обожженном клинкере не должно превышать 1% ив отдельных случаях при тонком измельчении цемента — 2%. Валовое содержание оксида магния в клинкере ограничено по ГОСТ — 5%.
При взаимодействии с водой щелочных соединений силиката и алюмината кальция (К20-23Са0- 12Si02 и Na20-8Ca0-ЗА1203) щелочи переходят в раствор. Гидратация клинкерной жидкости, застывшей при охлаждении в стекловидном состоянии, приводит к образованию твердых растворов вида С3(А, F)H6. В их составе в качестве изоморфных компонентов находятся силикатные образования типа природных минералов группы гранатов — c3fs3 и СзАБз, в которых произошло замещение 6Н20 на 3Si02. Образующиеся при этом гидратные соединения называются гидрогранатами (рис. 12) и имеют состав ЗСаО(А1, Fe)203-Si02(6— —2х)Н20, причем при нормальной температуре «*»’ может быть равен 0,5—0,7,
Гидратация цемента — что это такое?
14.09.2015 profipol_dp 958 просмотра
При смешивании цемента с водой присходит физико-химическая реакция, называемая гидратацией.
Гидратация вызывает твердение цементного клея и превращение его в прочный цементный камень.
Процесс твердения цементного камня ( бетона ) условно разделяется на две стадии:
- схватывание (кристаллизация, загустевание),
- твердение (набирание прочности)
Процесс схватывания начинается через 4-6 часов после смешивания цемента с водой и может длиться около суток, в зависимости от температуры окружающей среды.
Частички цемента начинают кристаллизоваться и связывают заполнитель цементного раствора или бетона (песок, щебень) между собой.
Бетон (раствор) начинает густеть, становится менее подвижным.
В зависимости от необходимости этот процесс можно ускорить или, наоборот, растянуть с помощью специальных добавок. Чаще всего это пластификаторы с комбинированными свойствами (ускоритель или замедлитель).

Условно говоря, через сутки начинается вторая стадия — твердение цементного камня (набор прочности). При идеальных условиях длится она 28 дней.
На начальном этапе ни о какой прочности не может идти и речи. Чатицы цемента кристаллизовались и скрепили заполнитель раствора вокруг себя, но эти соединения очень хрупкие и легко разрушаемые. При малейших механических воздействиях или подвижках эти соединения разрушаются и раствор уже никогда не свяжется и не затвердеет (не поможет и повторное заливание водой).
Пример 1: если походить по стяжке, которая только начала твердеть и набирать прочность, то разрушенные соединения раствора уже не схватятся между собой и стяжка начнет крошиться и высыпаться в этих местах.
Пример 2: кафель намного легче снять на следующий день после укладки, чем в сам день укладки. Пока клей вязкий плитку очень тяжело оторвать от стены (пола). На след.день клей кристаллизуется, но стоит только пару-тройку раз постучать по плитке кулаком (резиновым молотком), так она сразу легко снимется.
За первые 7 дней цементный камень набирает около 70% всей своей прочности, затем процесс твердения замедляется и за оставшиеся три недели он набирает еще около 20-25% прочности.

Существует мнение, что бетон набирает прочность первые сто лет своей «жизни» и еще сто лет он ее утрачивает, т.е. через двести лет бетон может стать критично слабым и разрушиться (привет балконам на «екатерининках» и «сталинках»).

Но для того, чтобы бетон продолжал набирать прочность — он постоянно должен поддерживаться во влажном состоянии.
В первые 2-3 недели желательно периодически проливать его водой и, при жаркой погоде или на сквозняке, накрывать пленкой, чтобы влага не испарялась быстро.
Если влага испарилась или замерзла в растворе, то процесс набора прочности останавливается.
Поэтому принудительное высушивание стяжки просто не допустимо.
Забудьте об открытых настеж окнах и дверях, включении ТП, тепловентиляторов и т.п.



