Может ли вода оставаться жидкой при температуре ниже нуля?
Может ли вода оставаться жидкой при температуре ниже нуля?
Да, может. Температура замерзания воды падает ниже нуля градусов по Цельсию, если вы оказываете на неё давление. И не только.
Это может произойти несколькими способами. Рассмотрим их далее.
Давление
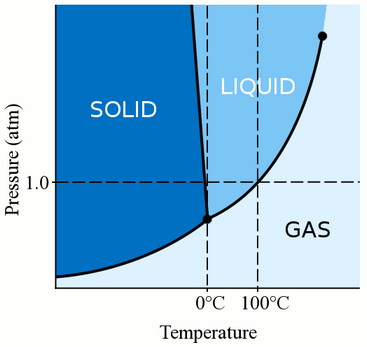
Прежде всего, фаза материала (будь то газ, жидкость или твёрдое вещество) сильно зависит как от его температуры, так и от давления.
Для большинства жидкостей давление поднимает температуру, при которой жидкость замерзает. Твёрдое тело образуется, когда свободные молекулы жидкости становятся достаточно медленными и достаточно близко располагаются друг к другу, чтобы сформировать стабильные связи, которые закрепляют их на месте. Когда мы оказываем давление на жидкость, мы заставляем молекулы сближаться. Поэтому они могут образовывать стабильные облигации и стать твёрдыми при более высокой температуре, чем температура замерзания при стандартном давлении.
Однако вода несколько уникальна.
Молекулы воды распространяются, когда они связываются в твёрдую кристаллическую структуру. Это действие делает лёд менее плотным, чем жидкостная вода, поэтому лёд плавает, а не тонет. Это действие молекул воды при замерзании также означает, что давление воды понижает температуру замерзания. Если вы примените достаточное давление (что затрудняет распространение молекул воды в твёрдую структуру), вы можете получить жидкую воду на несколько градусов ниже нуля градусов по Цельсию.
Добавки
Даже без давления вы можете получить жидкую воду при минусовой температуре, используя добавки. Такие добавки, как соль, могут помешать сформировать твёрдое тело и понизить температуру замерзания воды.
Соль состоит из сильных ионов натрия и хлора. Растворённые в воде, молекулы воды присоединяются к ионам соли, и поэтому не замерзают как охотно. По мере того, как вы добавляете больше соли в воду, точка замерзания продолжает падать, пока вода не достигнет насыщения и не сможет удерживать соль.
Если добавить достаточное количество соли, температура замерзания воды может упасть до -21 градуса Цельсия.
Этот факт означает, что вода при температуре -21 градус Цельсии может всё ещё быть жидкой (с достаточным количеством соли).
Это мощное свойство соли можно также использовать для того, чтобы дать льду превратиться обратно в воду. Посыпание солью ледяных тротуаров снижает температуру замерзания льда ниже температуры окружающей среды, и лёд тает.
Но посыпать солью обледеневшие дорожки не поможет, если температура окружающей среды ниже -21 градуса по Цельсию.
Воздействие соли на точку замерзания воды также оказывает глубокое воздействие на океаны Земли.
Другие методы. Переохлаждённая вода
Даже если вы не применяете давление и ничего не добавляете в воду, вы всё равно можете иметь жидкую воду при температуре ниже нуля градусов по Цельсию.
Для того, чтобы вода замёрзла до льда, ей нужно замёрзнуть, чтобы начать процесс. Эти отправные точки называются «центрами нуклеации». В большинстве случаев немного пыли, примесей или даже небольшие колебания в воде обеспечивают центры зарождения для замерзания воды. Но если ваша вода очень чистая и неподвижная, молекулам воды не на что кристаллизоваться. В результате вы можете охладить очень чистую воду ниже нуля градусов по Цельсию без замерзания.
Вода в таком состоянии называется «переохлаждённой».
Чистую воду можно переохладить до около -40 градус Цельсия.
Переохлаждённая вода удерживается от замерзания только отсутствием центров зарождения. Поэтому, как только появятся центры нуклеации (что может произойти от простой вибрации), супер-охлаждённая вода быстро замерзает.
Ледяной дождь — это естественный пример переохлаждённой жидкой воды. Как только дождь попадает на объект на поверхности Земли, объект обеспечивает центры нуклеации, и дождь замерзает до льда.
Какой обьект обеспечивает какие центры нуклеации? Что спрятано за этими терминами? — незнание!
5 аномальных фактов о воде
Несмотря на простую химическую формулу, вода — вещество с очень необычными свойствами. Она таит в себе множество загадок, которые порой не под силу разгадать даже ученым.
Перед вами пять наиболее интересных фактов о воде.
1. Горячая вода замерзает быстрее холодной
Возьмем две емкости с водой: в одну нальем горячую, а в другую — холодную воду, и поместим их в морозильную камеру. Горячая вода замерзнет быстрее холодной, хотя по логике вещей, первой должна была превратиться в лед холодная вода: ведь горячей воде надо сначала остыть до температуры холодной, а потом уже превращаться в лед, в то время как холодной воде остывать не надо.
Почему же так происходит?
В 1963 году один танзанский студент по имени Эрасто Б. Мпемба (Erasto B. Mpemba) замораживая приготовленную смесь для мороженого, заметил, что горячая смесь застывает в морозильной камере быстрее, чем холодная. Когда юноша поделился своим открытием с учителем физики, тот лишь посмеялся над ним.
К счастью, ученик оказался настойчивым и убедил учителя провести эксперимент, который и подтвердил его открытие: в определенных условиях горячая вода действительно замерзает быстрее холодной.
Теперь этот феномен горячей воды, замерзающей быстрее холодной, носит название «эффект Мпемба». Правда, за долго до него это уникальное свойство воды было отмечено Аристотелем, Фрэнсисом Бэконом и Рене Декартом.
Ученые так до конца и не понимают природу этого явления, объясняя его либо разницей в переохлаждении, испарении, образовании льда, конвекции, либо воздействием разжиженных газов на горячую и холодную воду.
2. Сверхохлаждение и «мгновенное» замерзание
Все знают, что вода всегда превращается в лед при охлаждении до 0 °C … за исключением некоторых случаев! Таким случаем, например, является сверхохлаждение, которое представляет собой свойство очень чистой воды оставаться жидкой, даже будучи охлажденной до температуры ниже точки замерзания.
Это явление становится возможным благодаря тому, что окружающая среда не содержит центров или ядер кристаллизации, которые могли бы спровоцировать образование кристаллов льда. И поэтому вода остается в жидкой форме, даже будучи охлажденной до температуры ниже нуля градусов по Цельсию.
Процесс кристаллизации может быть спровоцирован, например, пузырьками газа, примесями (загрязнениями), неровной поверхностью емкости. Без них вода будет оставаться в жидком состоянии. Когда процесс кристаллизации запускается, можно наблюдать, как сверхохлажденная вода моментально превращается в лед.
Заметьте, что «сверхнагретая» вода также остается жидкой, даже будучи нагретой до температуры выше точки закипания.

3. «Стеклянная» вода
Не задумываясь, назовите, сколько различных состояний есть у воды? Если вы ответили три: твердое, жидкое, газообразное, то вы ошиблись. Ученые выделяют как минимум 5 различных состояний воды в жидком виде и 14 состояний в замерзшем виде.
Помните разговор про сверхохлажденную воду? Так вот, что бы вы ни делали, при температуре -38 °C даже самая чистая сверхохлажденная вода внезапно превратится в лед.
Что же произойдет при дальнейшем понижении температуры?
При -120 °C с водой начинает происходить что-то странное: она становится сверхвязкой или тягучей, как патока, а при температуре ниже -135 °C она превращается в «стеклянную» или «стекловидную» воду – твердое вещество, в котором отсутствует кристаллическая структура.
4. Квантовые свойства воды
На молекулярном уровне вода удивляет ещё больше. В 1995 году проводимый учеными эксперимент по рассеянию нейтронов дал неожиданный результат: физики обнаружили, что нейтроны, направленные на молекулы воды, «видят» на 25% меньше протонов водорода, чем ожидалось.
Оказалось, что на скорости одной аттосекунды (10 -18 секунд) имеет место необычный квантовый эффект, и химическая формула воды вместо H2O, становится H1.5O!
5. Есть ли у воды память?
Альтернативная официальной медицине гомеопатия утверждает, что разбавленный раствор лекарственного препарата может оказывать лечебный эффект на организм, даже если коэффициент разбавления настолько велик, что в растворе уже не осталось ничего, кроме молекул воды.
Сторонники гомеопатии объясняют этот парадокс концепцией под названием «память воды», согласно которой вода на молекулярном уровне обладает «памятью» о веществе, некогда в ней растворенном и сохраняет свойства раствора первоначальной концентрации после того, как в нём не остается ни одной молекулы ингредиента.

Международная группа ученых во главе с профессором Мэдлин Эннис (Madeleine Ennis) из Королевского университета в Белфасте (Queen’s University of Belfast), критиковавшая принципы гомеопатии, в 2002 году провела эксперимент, чтобы раз и навсегда опровергнуть эту концепцию.
Результат оказался обратным. После чего, ученые заявили, что им удалось доказать реальность эффекта «памяти воды». Однако опыты, проведенные под наблюдением независимых экспертов, результатов не принесли. Споры о существовании феномена «памяти воды» продолжаются.
Вода обладает множеством других необычных свойств, о которых мы не рассказали в этой статье. Например, плотность воды меняется в зависимости от температуры (плотность льда меньше плотности воды); вода обладает довольно большой величиной поверхностного натяжения; в жидком состоянии вода представляет собой сложную и динамически меняющуюся сеть из водных кластеров, и именно поведение кластеров влияет на структуру воды и т.д.
Как происходит замерзание дистиллированной воды, при какой температуре?

Существующая точка зрения о том, что дистиллированная вода не замерзает даже при минусовой температуре, не совсем верна. Процесс замерзания несколько отличается от аналогичного процесса, происходящего с обычной водой.
Замерзание такого состава зависит от ряда факторов. Имеет значение, в каких условиях находится дистиллированная вода. Также важно следовать рекомендациям в ситуациях, когда дистиллят нужно использовать, но он замерз.
Может и должна ли замораживаться?
 Дистиллированная вода может замерзнуть. Но этот процесс начинает происходить при более низкой температуре.
Дистиллированная вода может замерзнуть. Но этот процесс начинает происходить при более низкой температуре.
Если в обычной воде кристаллы льда появляются уже при 0 0 С, то дистиллят замерзает только при твердом минусе.
В неочищенной воде имеются соли с прочими примесями. Из-за них в такой воде много центров кристаллизации. Дистиллированный раствор практически не имеет центров кристаллизации.
Почему существует утверждение, что дистиллят не превращается в лед?
Данное мнение основывается на свойствах такого состава. В нем отсутствуют примеси. Именно из-за них простая вода замерзает уже при 0 0 С. Поскольку в очищенных растворах примесей не имеется, то считается, что они могут оставаться в жидком состоянии даже при минусе.
От каких факторов зависит температура кристаллизации?
 Температура замерзания стерильного раствора зависит от следующих факторов:
Температура замерзания стерильного раствора зависит от следующих факторов:
- наличие посторонних примесей;
- концентрация посторонних включений;
- условия внешней среды, в которых находится очищенная смесь.
Играет роль внешнее воздействие на тару с дистиллированной водой. Даже стерильный раствор при добавлении в него небольшого количества посторонних примесей начнет быстро кристаллизоваться даже при слабом минусе.
Отличие в заморозке дистиллята от обычной воды
Замораживание дистиллята отличается от заморозки простой воды более низкой точкой замерзания. Чем состав чище, тем ниже температура потребуется ему для полного превращения в лед. Водопроводная вода превратится в лед уже при 0 0 С.
Отличие также кроется в центрах кристаллизации. В очищенной воде их нет из-за отсутствия в ней примесей. В обычной воде таких центров кристаллизации очень много. По этой причине она быстрее охлаждается.
 Замораживание обычной воды происходит быстрее, чем дистиллированной.
Замораживание обычной воды происходит быстрее, чем дистиллированной.
Очищенный состав кристаллизуется более длительное время. Фрагменты льда в такой воде формируются постепенно.
Обычная вода покрывается льдом по всей поверхности. Замораживание начинается снизу и движется вверх. В дистилляте этот процесс идет сверху вниз.
Температура превращения в лед
Скорость превращения очищенной воды в лед зависит от условий, в которых она находится. Дистиллированная смесь, находящаяся на улице и внутри аккумулятора машины, замерзает при разной температуре. В двух указанных случаях отмечается разная точка замерзания.
На улице
В уличных условиях очищенный состав кристаллизуется довольно быстро. На открытом воздухе нет факторов, препятствующих быстрому переходу раствора в состояние льда.
Качественный дистиллят на улице может замерзнуть при -10 0 С. Это значение является точкой замерзания. Но часто имеющиеся в продаже составы превращаются в лед при температурном режиме от -1 до -5 0 С.
В аккумуляторе
Поскольку в данном случае очищенная вода находится внутри аккумуляторной батареи, то процесс ее замерзания будет происходить медленнее. Но это касается случаев, если дистиллят заливается в прогретый аккумулятор. Он остывает медленно. При слабом минусе дистиллят внутри него не успеет заморозиться.
Как происходит процесс?
Процесс происходит следующим образом:
 Состав при снижении температуры охлаждается все больше.
Состав при снижении температуры охлаждается все больше.- При достижении точки замерзания пространство между молекулами увеличивается.
- В верхней части емкости сначала формируется ледяная шапка, которая начинает расти вниз.
- Замораживание идет сверху вниз, пока не доходит до дна емкости.
В процессе замораживания объем дистиллированной смеси становится больше почти на 10%.
Что делать, при замерзании?
В обычных условиях заморозка дистиллята не создает проблем. Замерзший состав необходимо поставить в отапливаемое помещение и подождать.
Когда он оттает и достигнет комнатной температуры, его можно продолжить использовать по назначению. Свойства такого раствора не изменятся.
Не следует ускорять размораживание дистиллированной воды. Нельзя ее нагревать. При данном процессе раствор перестанет быть чистым. В него попадут посторонние примеси из тары, в которой он нагревается.
Если дистиллят замерз внутри аккумулятора, то необходимо предварительно снять его с автомобиля и положить в теплое помещение. Батарея должна оттаять сама при комнатной температуре.
 Нельзя нагревать ее или включать в процессе размораживания. После обязательно требуется проверить состояние пластин батареи.
Нельзя нагревать ее или включать в процессе размораживания. После обязательно требуется проверить состояние пластин батареи.
Дистиллят в состоянии льда из-за своего расширения может повредить их, приведя в негодность весь аккумулятор.
Только после тщательной проверки батареи можно устанавливать ее обратно на автомобиль и продолжать им пользоваться. Часто замерзшая дистиллированная вода в аккумуляторе является причиной его поломки. В таких ситуациях дистиллят сливается, а батарея либо отдается в ремонт, либо заменяется на новую.
Заключение
Дистиллированная вода способна к замораживанию, но при более низких температурных показателях, чем обычная вода. Это обусловлено отсутствием в ней примесей и центров кристаллизации.
Качественный дистиллят замерзает при -10 0 С. Очищенные растворы могут начать замерзать и при более низких температурных режимах. В лабораторных условиях такие составы могут превратиться в лед только при -42 0 С.
На улице раствор замерзает быстрее, чем внутри аккумуляторной батареи. Но если аккумулятор в машине не прогрет, то внутри него очищенная вода может замерзнуть даже при -3 0 С. Замерзшую дистиллированную воду можно разморозить и продолжить использовать.
Форум Тетис
Ведущий форум о рекреационном и техническом дайвинге, подводной охоте и фридайвинге
- Темы без ответов
- Активные темы
- Поиск
- Наша команда
- Список форумовТематические форумыДайвинг
- Поиск
- Темы без ответов
- Активные темы
бывает ли солёная вода -3 градуса?
![]()
#1 Сообщение Sandro » 07-09-2007 10:50 —> Добавлено: 07-09-2007 10:50 Заголовок сообщения: бывает ли солёная вода -3 градуса?
![]()
#2 Сообщение BeerFood » 07-09-2007 11:06 —> Добавлено: 07-09-2007 11:06 Заголовок сообщения: Re: бывает ли солёная вода -3 градуса?
#3 Сообщение Paul_S » 07-09-2007 11:08 —> Добавлено: 07-09-2007 11:08 Заголовок сообщения:
![]()
#4 Сообщение Sandro » 07-09-2007 11:14 —> Добавлено: 07-09-2007 11:14 Заголовок сообщения:
#5 Сообщение Paul_S » 07-09-2007 11:32 —> Добавлено: 07-09-2007 11:32 Заголовок сообщения:
![]()
#6 Сообщение Sandro » 07-09-2007 11:43 —> Добавлено: 07-09-2007 11:43 Заголовок сообщения:
![]()
#7 Сообщение Mikle » 07-09-2007 13:01 —> Добавлено: 07-09-2007 13:01 Заголовок сообщения:
![]()
#8 Сообщение Mikle » 07-09-2007 13:05 —> Добавлено: 07-09-2007 13:05 Заголовок сообщения: Re: бывает ли солёная вода -3 градуса?
![]()
#9 Сообщение VVG » 07-09-2007 13:07 —> Добавлено: 07-09-2007 13:07 Заголовок сообщения:
#10 Сообщение Ricksha » 07-09-2007 13:17 —> Добавлено: 07-09-2007 13:17 Заголовок сообщения:
Вариант с переохлажденной водой рассматривать не имеет смысла, т.к. в природных условиях данное явление недостижимо, и как правильно было отмечено, при возникновении центра кристаллизации такая вода мгновенно перешла бы в твердую фазу (лед). Ваш друг погрузившись в воду сыграл бы роль центра кристаллизации и мгновенно оказался бы в куске льда.
Также фантастическим смотрится вариант с тяжелой (дейтериевой) водой. Такая вода действительно имеет температуру плавления -3,8°С, но в чистом виде в природе не встречается. Тяжелая вода содержится в обычной природной воде в чрезвычайно низкой концентрации, извлекается искусственно и стоит больших денег.
При температуре -4°С обычная (протиевая) вода может оставаться в жидком состоянии только при наличии примесей. Это может быть и морская соль, и другие соединения (спирт и т.п.). Вполне возможно, что в реку произошел выброс химических соединений, которые сыграли роль антифриза. Также не стоит исключать погрешность или неисправность термометра.
#11 Сообщение Paul_S » 07-09-2007 18:20 —> Добавлено: 07-09-2007 18:20 Заголовок сообщения:
При температуре -4°С обычная (протиевая) вода может оставаться в жидком состоянии только при наличии примесей. Это может быть и морская соль, и другие соединения (спирт и т.п.). Вполне возможно, что в реку произошел выброс химических соединений, которые сыграли роль антифриза. Также не стоит исключать погрешность или неисправность термометра.
Тайная жизнь воды при очень низких температурах
Тайная жизнь воды стала еще более сверхъестественной
Тайная жизнь воды стала еще более сверхъестественной. Долгие годы вода, как известно, существовала в 15 фазах — не только в твердых, жидких и газообразных состояниях, известных еще с начальной школы. Теперь, химики американского университета штата Юта подтвердили сосуществование льда и жидкой воды после того, как она кристаллизуется при очень низких температурах.

Они описывают свою работу в новом номере «Журнала химической физики», издаваемым Американским институтом физики.
Чтобы провести этот вид исследований льда, одной только «соломинки» для размешивания коктейля и шейкера недостаточно. Нужна температура около минус 93 градусов по Цельсию, чрезвычайно низкая температура, характерная для верхних слоев атмосферы, называемых «нейтральной зоной» воды из-за странного размывания границ двух водных фаз — жидкости и льда — царящего там.
Валерия Молинеро (Valeria Molinero), которая привела это исследование говорит: «Наши результаты показывают путь, ведущий к такому поведению воды и к формированию облаков».
Молинеро и аспирант Эмили Мур обнаружили, что при — 93 град. по Цельсию быстрая кристаллизация льда затрудняет наблюдение за процессом.
Поскольку молекулы движутся слишком быстро, чтобы за ними наблюдать в лабораторных условиях, ученые прибегли к компьютерному моделированию.
Их работа может иметь важное значение для понимания образований облаков, регулирующих процесс глобального излучения (прямое солнечное излучение + диффузное излучение неба) и, следовательно, изменение климата. Хотя это является благом для понимания переохлажденной воды и ее роли в формировании облаков, этот прорыв знаменателен для тех, кого так привлекает так называемый парк развлечений физики «нейтральной зоны» («ничьей земли»). Ведь однажды, они смогут поиграть в хоккей даже во время купания.
Самый простой способ приготовления талой воды

Польза талой воды заключается также в том, что в ней, в отличие от водопроводной, нет дейтерия – тяжелого элемента, который подавляет все живое и наносит серьезный вред организму.
Живительная сила талой воды
Водопроводная вода состоит из разнородных молекул, значительная часть которых вообще не участвует в обмене веществ. В идеале нужно, чтобы молекулы воды были меньше клеточной мембраны и свободно проходили через нее для ускорения обмена веществ. Только не надо думать, что речь пойдет о каких-то супердорогих установках для преобразования обычной водопроводной воды в идеальную. Природа обо всем позаботилась сама.
Такая «живая» вода есть в природе. Это талая вода, которая получается из снега и льда.
Помните, как бабушки по весне собирают снег, чтобы поливать этой водой рассаду на подоконниках? О цветочках мы заботимся, а о собственном здоровье не всегда.
Талая вода способствует омоложению всего организма. К тому же при активном обмене веществ из организма выводятся старые, разрушенные клетки, которые мешают образованию новых, молодых. В результате этого процесс старения замедляется. Известно, что основным общим признаком для всех групп долгожителей нашей планеты является то, что они пьют маломинерализованную талую воду из ледниковых рек.
Например, жители пакистанского городка Хунзакут живут по 100-120 лет. Зарегистрированы случаи, когда мужчины старше 100 лет становились отцами. Известны долгожители и в горах Кавказа, и в Якутии.
От воды сильно зависят птицы. Они возвращаются весной в наши края из благодатных южных широт во время таяния снегов и льда и пьют талую воду. Без нее невозможно размножение пернатых.
Дейтерий в больших концентрациях равнозначен самым сильным ядам. Он тяжело усваивается, что требует дополнительного расхода энергии. Талая же вода сама по себе обладает большой внутренней энергией и обеспечивает человеку хорошую энергетическую подпитку.
Если вы будете ежедневно выпивать хотя бы 1 — 2 стакана такой воды, то значительно улучшите свое самочувствие. Нормализуется деятельность сердца, сосудов головного и спинного мозга. Улучшается состав крови и работа мышц. Талая вода особенно полезна в разгрузочные дни или при лечении голодом. Она способствует быстрому выведению токсинов.
Приготовить такую «живую» воду легко и в домашних условиях. Для этого есть несколько способов. Какой из них лучше, выбирайте сами.
Способ 1. Заморозить сырую воду в обычном холодильнике – наполнить кастрюлю, например, и поставить ее на лист фанеры или картона в морозилку. После полного замерзания воды дать ей растаять при комнатной температуре.
Способ 2. Дает возможность полностью удалить дейтерий. Когда вода начинает замерзать, удалите только что образовавшуюся корочку льда. Это дейтерий, он замерзает в первую очередь. После того как заледенеет основная масса воды, ополосните застывший кусок под краном струей холодной воды. Кусок должен стать прозрачным, так как вода удалит изо льда вредные примеси. Далее растопите лед и пейте полученную талую воду.
Способ 3. Небольшое количество жидкости нагревают до температуры 94–96 градусов. Вода еще не кипит, но уже струйками поднимаются пузыри. В этот момент кастрюлю снимают и воду резко охлаждают, затем замораживают и оттаивают. Приготовленная таким способом талая вода проходит все фазы своего круговорота в природе: испаряется, охлаждается, замерзает и тает. Эта вода особенно полезна – она обладает огромной внутренней энергией.
Способ 4. Воду (если водопроводную, то отстоявшуюся в течение нескольких часов для освобождения от растворенных газов) охлаждают в холодильнике до появления первого льда. Этот лед вылавливают и выбрасывают, так как в нем концентрируются те примеси, что «предпочитают» твердую фазу. Оставшуюся воду морозят дальше, пока большая ее часть (но не вся) превратится в лед. Этот лед вылавливают и используют по назначению. Оставшуюся жидкость выливают, так как в ней концентрируются примеси, «предпочитающие» жидкую фазу. Потеря объема составляет ориентировочно 5% в начале и 10% в конце.
Способ 5. Вода не только приобретает характерную структуру, но и отлично очищается от многих солей и примесей. Для этого холодную воду выдерживают в морозильнике до тех пор, пока примерно половина ее не замерзнет. В середине объема остается незамерзшая вода, которую выливают. Можно протыкать лед шилом, раскалив его на огне, или как-то разламывать – в общем, так или иначе, воду надо удалить. Лед же оставляют таять. Главное — экспериментальным путем установить время, требуемое для замерзания половины объема. Это может быть и 6, и 16 часов. Идея заключается в том, что сначала замерзает чистая вода, большинство же соединений остается в растворе.
Способ 6. Для большего эффекта можно воспользоваться двойным очищением. Сначала дать воде отстояться, затем заморозить ее. Дождаться, когда образуется тонкий первый слой льда. Этот лед удаляют — в нем содержатся некоторые вредные быстрозамерзающие соединения. Затем повторно замораживают воду — уже до половины объема — и удаляют незамерзшую фракцию воды. Получится очень чистая и целебная вода. Талую воду нужно пить сразу после того, как лед растает. Также можно готовить на ней пищу, но при нагревании она теряет свои лечебные свойства, хотя при этом остается гораздо более чистой, чем простая вода, пропущенная через фильтр.
УПОТРЕБЛЕНИЕ ТАЛОЙ ВОДЫ
В течение дня желательно выпивать 1-2 стакана холодной талой воды (с кусочками льда): первый — рано утром за час до еды, второй – в течение дня, также за час до очередного приема пищи.
Рецепт получения 7
Для получения талой воды в городских условиях можно в качестве исходного материала взять обычную водопроводную воду из-под крана. Но, как говорил Михаил Жванецкий, если вас интересует конечный результат. Лучше использовать очищенную или, в крайнем случае, охлажденную кипяченую воду. Вода наливается в ёмкость и ставится в морозильную камеру.
При этом желательно чтобы ёмкость была стеклянной (стекло, в отличие от пластика, инертно и, в отличие от металла, прозрачно), заполнена водой на 3/4 или хотя бы на 4/5, установлена на сухую картонную подставку (которая не примёрзнет ни к вашей ёмкости, ни к донышку морозилки). После этого остаётся лишь поглядывать время от времени — как идёт процесс заморозки.
К моменту, когда половина (или чуть больше) воды превратится в лёд, ёмкость извлекают из морозилки и сливают не успевшую замерзнуть жидкость. В ней остались примеси, от которых и следовало избавиться. Оставшийся лёд выставляется на оттаивание – это и будет целительная талая вода. При температуре 18 — 20°С она будет эффективной ещё 10 — 12 часов.
Некоторые, рекомендуют при замораживании воды удалять первый лёд – тонкую корку, схватившуюся на поверхности. Мотивируют это тем, что вредный дейтерий замерзает раньше воды.
И действительно, температура перехода дейтерия в твёрдое агрегатное состояние составляет 3,82°С, но, во-первых, его плотность выше, чем у воды, поэтому он не может оказаться над её поверхностью, а во-вторых, для получения 1 г дейтерия понадобилось бы не меньше 40 л воды, что позволяет предположить: в 3 л его менее 0,1 г. Впрочем, это уже на ваше усмотрение. Будьте здоровы!
Источник: h  ttp://vredna.ru/polza-taloy-vody
ttp://vredna.ru/polza-taloy-vody
Температура воды в жидком состоянии

Всем известны границы температур у воды. Это нулевая температура, при которой вода превращается в лед, а также 100 градусов по Цельсию, которые обозначают испарение. О том, что вода может превратиться в пар гораздо медленнее, но и при более низкой температуре, вы наверняка уже узнали, а вот какие могут быть температуры у воды в ее обычном состоянии?
Начнем с того, что воду можно просто посолить. Сделать это нетрудно, достаточно всего лишь одной ложки соли на стакан. Проведите этот опыт у себя дома, вынесите воду на улицу зимой, поставьте ее в холодильник, если снаружи недостаточно холодно. Сделав это, проверьте, при какой температуре вода все еще никак не может замерзнуть. Соленость в 0,35 промилле, стандартная для морей, понижает температуру замерзания воды до -1,9 градуса, тогда как 0,3 промилле дают -1,6 градуса. Можно провести опыт еще несколько раз, добавив больше соли в жидкость, чтобы узнать, какая жидкость не замерзнет при -5.
Вообще, если продолжить разговор о соленой воде, то у нее есть еще множество параметров, которые изменяются в зависимости от уровня солености, тогда как есть и прочие особенности. Конечно, температура воды при повышенном давлении оказывается в больших рамках, нежели при нормальном. Более того, когда температура кипения сдвигается вверх при повышении давления, что означает порой увеличение диапазона, можно ожидать, что и температура замерзания жидкости будет повышаться. Как это можно объяснить? Только тем, что при повышенном давлении кинетическая энергия молекул будет уменьшаться. Но на самом деле происходит совершенно обратное явление.
Уравнение с абсолютной температурой
 Согласно уравнению Менделеева-Клапейронаможно доказать, что температура замерзания сдвигается вниз, то есть, при увеличении давления в несколько десятков раз можно получить температуру меньше на 10-15 градусов. То есть, вполне можно объяснить наличие воды на других планетах не в жидком, а в твердом состоянии: если давление будет меньше, чем на Земле, то и замерзать она будет при более высоких температурах. Поэтому некоторые явления очень легко объяснить только при помощи законов и уравнений, а не при помощи наблюдений.
Согласно уравнению Менделеева-Клапейронаможно доказать, что температура замерзания сдвигается вниз, то есть, при увеличении давления в несколько десятков раз можно получить температуру меньше на 10-15 градусов. То есть, вполне можно объяснить наличие воды на других планетах не в жидком, а в твердом состоянии: если давление будет меньше, чем на Земле, то и замерзать она будет при более высоких температурах. Поэтому некоторые явления очень легко объяснить только при помощи законов и уравнений, а не при помощи наблюдений.
Если же вернуться к соленой воде, то можно легко провести еще один опыт, который покажет, что расширение температурных границ продолжается и при кипении. То есть, соленая вода кипит при более высокой температуре. Давайте же более подробно рассмотрим тот процесс, который происходит в жидкости, когда в ней растворяют больше соли.
После того, как в жидкость опустили ложку с солью, она превращается в соляной раствор. Это уже обыкновенная химия, но мы будем видеть этот процесс с несколько иной точки зрения. Пусть у нас есть два вещества: вода и соль. Теплоемкости и прочие физические параметры, связанные с изменением температуры, различные у разных веществ, поэтому нетрудно понять, что для того, чтобы соль смерзлась или расплавилась при нагревании, требуется другое количество энергии. Когда в воде оказывается соль, то у раствора за некоторой погрешностью оказывается средняя температура замерзания и кипения, чем у соответствующих веществ. Получается это за счет того, что масса соли намного меньше, чем масса воды: одна ложка против одного стакана дает большую разницу.
Соляной раствор воды
 Растворенная соль, однако, не просто заполняет пространство между молекулами воды. Она образует сложные химические связи, для разрыва которых тоже требуется энергия. Именно об этом шла речь, когда говорилось о небольшой погрешности. Ионные связи между солью и водой образуются в достаточной степени, поэтому разделить эти вещества не представляется возможным, кроме как при помощи сложных химических реакций или же простого испарения. Таким образом, когда соли в жидкости растворено оптимальное количество, можно говорить о том, что энергии для нагревания или кристаллизации потребуется гораздо больше.
Растворенная соль, однако, не просто заполняет пространство между молекулами воды. Она образует сложные химические связи, для разрыва которых тоже требуется энергия. Именно об этом шла речь, когда говорилось о небольшой погрешности. Ионные связи между солью и водой образуются в достаточной степени, поэтому разделить эти вещества не представляется возможным, кроме как при помощи сложных химических реакций или же простого испарения. Таким образом, когда соли в жидкости растворено оптимальное количество, можно говорить о том, что энергии для нагревания или кристаллизации потребуется гораздо больше.
Вообще, у воды есть множество веществ-«друзей», если можно так сказать. Это не только классическийNaCl, который рассыпают на улицах зимой, который можно положить в кастрюлю с супом или в любое другое блюдо. Это множество других солей, различных минералов, которые могут образовать аналогичные соединения в воде. Все они в той или иной степени повышают количество теплоты, необходимое для перехода в другое состояние, относительно жидкого. Поэтому получается, что в жидком состоянии вода может существовать в гораздо большем диапазоне температур.
Теперь точно известно, что в жидком состоянии можно держать воду при помощи химических связей и повышенного давления. Нетрудно догадаться, что все это необходимо для проведения разнообразных опытов с энергией: ведь именно в воде сосредоточено достаточно большое количество запасов энергии.
Вода при замерзании расширяется или сжимается: простая физика

Многие юные почемучки задаются вопросом: при замерзании вода расширяется или сжимается? Ответ следующий: с приходом зимы вода начинает свой процесс расширения. Почему это происходит? Это свойство выделяет воду из списка всех остальных жидкостей и газов, которые, наоборот, сжимаются при охлаждении. В чем заключается причина такого поведения этой необычной жидкости?
Физика 3 класса: вода при замерзании расширяется или сжимается?
Большинство веществ и материалов увеличиваются в объеме при нагревании и уменьшаются при охлаждении. Газы этот эффект показывают более заметно, но различные жидкости и твердые металлы проявляют такие же свойства.

Одним из наиболее ярких примеров расширения и сжимания газа является воздух в воздушном шаре. Когда мы выносим воздушный шар на улицу в минусовую погоду, то шар сразу уменьшается в размерах. Если мы шар вносим в отапливаемое помещение, то он сразу же увеличивается. А вот если мы внесем воздушный шар в баню — он лопнет.
Молекулы воды требуют больше места
Причиной тому, что происходят эти процессы расширения и сжатия различных веществ, являются молекулы. Те из них, которые получают больше энергии (это происходит в теплом помещении), двигаются намного быстрее, чем молекулы, находящиеся в холодном помещении. Частицы, которые имеют большую энергию, сталкиваются намного активнее и чаще, им необходимо больше места для движения. Чтобы сдержать то давление, которое оказывают молекулы, материал начинает увеличиваться в размерах. Причем это происходит достаточно стремительно. Итак, вода при замерзании расширяется или сжимается? Почему это происходит?
Вода не подчиняется этим правилам. Если мы начинаем охлаждать воду до четырех градусов Цельсия, то она уменьшает свой объем. Но если температура продолжает падать, то вода вдруг начинает расширяться! Существует такое свойство, как аномалия плотности воды. Это свойство возникает при температуре в четыре градуса Цельсия.

Теперь, когда мы выяснили, расширяется или сжимается вода при замерзании, давайте узнаем, как вообще возникает эта аномалия. Причина таится в частицах, из которых она состоит. Молекула воды создана из двух атомов водорода и одного — кислорода. Формулу воды все знают еще с начальных классов. Атомы в этой молекуле притягивают электроны по-разному. У водорода создается положительный центр тяжести, а у кислорода, наоборот — отрицательный. Когда молекулы воды сталкиваются друг с другом, то атомы водорода одной молекулы переходят на атом кислорода совершенно другой молекулы. Этот феномен называется водородной связью.
Воде нужно больше места при ее охлаждении
В тот момент, когда начинается процесс формирования водородных связей, в воде начинают возникать места, где молекулы находятся в том же порядке, что и в кристалле льда. Эти заготовки называются кластерами. Они не прочны, как в твердом кристалле воды. При повышении температуры они разрушаются и меняют свое местоположение.
Во время процесса охлаждения воды начинает стремительно увеличиваться количество кластеров в жидкости. Они требуют больше пространства для распространения, вследствие этого вода и увеличивается в размерах после достижения своей аномальной плотности.

При падении столбика термометра ниже нуля кластеры начинают превращаться в мельчайшие кристаллы льда. Они начинают подниматься вверх. Вследствие всего этого вода превращается в лед. Это очень необычная способность воды. Данный феномен необходим для очень большого количества процессов в природе. Мы все знаем, а если не знаем, то запоминаем, что плотность льда незначительно меньше плотности прохладной или же холодной воды. Благодаря этому лед плавает на поверхности воды. Все водоемы начинают замерзать сверху вниз, что позволяет спокойно существовать и не замерзать водным обитателям на дне. Итак, теперь мы в подробностях знаем о том, расширяется или сжимается вода при замерзании.
Интересный феномен
Горячая вода замерзает быстрее холодной. Если мы возьмем два одинаковых стакана и нальем в один горячей воды, а в другой столько же холодной, то мы заметим, что горячая вода замерзнет быстрее, чем холодная. Это не логично, согласитесь? Горячей воде нужно остыть, чтобы начинать замерзать, а холодной этого не нужно. Как объяснить данный факт? Ученые по сей день не могут объяснить эту загадку. Данный феномен имеет название «Эффект Мпембы». Открыт был в 1963 году ученым из Танзании при необычном стечении обстоятельств. Студент хотел сделать себе мороженое и заметил, что горячая вода замерзает быстрее. Об этом он поделился со своим учителем физики, который сначала не поверил ему.
При какой температуре замерзает вода?
При какой температуре замерзает вода?
Ответ на этот вопрос представляется очевидным – при 0 градусов Цельсия, – однако он не совсем корректен. Если подвергнуть медленному охлаждению очень чистую (лучше всего дистиллированную) воду, то она может оставаться жидкой и при температуре в несколько градусов ниже нуля. Однако, если в эту переохлажденную воду бросить маленький кусочек льда, щепотку снега или просто пыли, вода мгновенно замерзнет, прорастая по всему объему длинными кристаллами. Столь странное поведение воды объясняется особенностями процесса кристаллизации. Превращение жидкости в кристалл происходит в первую очередь на примесях и неоднородностях – частичках пыли, пузырьках воздуха, царапинах на стенках сосуда. Чистая вода центров кристаллизации практически лишена, поэтому она может переохлаждаться (и довольно сильно), оставаясь жидкой. Известен случай, когда содержимое хорошо охлажденной в морозильнике бутылки нарзана, открытой жарким летним днем, мгновенно превратилось в кусок льда. В лабораторных условиях температуру воды, правда, в очень малых объемах, удавалось довести до – 70 градусов Цельсия.
Данный текст является ознакомительным фрагментом.
Читать книгу целиком
Похожие главы из других книг:
При какой температуре закипает вода на высочайшей вершине мира – Джомолунгме?
При какой температуре закипает вода на высочайшей вершине мира – Джомолунгме? Температура кипения – фазового перехода из жидкого в газообразное состояние (и наоборот) – воды, как и любого другого вещества, возрастает с увеличением внешнего давления. При стандартном
При какой температуре вода имеет максимальную плотность?
При какой температуре вода имеет максимальную плотность? Еще из школьного курса физики мы знаем, что при нагревании все вещества – твердые, жидкие и газообразные – расшираются. Вода является одним из немногих исключений из этого правила, она имеет максимум плотности
Почему вода в глубоководном озере кажется голубой, а чистая вода из крана – бесцветной?
Почему вода в глубоководном озере кажется голубой, а чистая вода из крана – бесцветной? Солнечный свет, который мы иногда называем белым, содержит в себе все длины волн оптического диапазона – так называемые спектральные цвета – от инфракрасного до ультрафиолетового.
У какой из планет Солнечной системы наиболее вытянутая орбита и у какой наименее?
У какой из планет Солнечной системы наиболее вытянутая орбита и у какой наименее? Как известно, любая планета обращается вокруг своей звезды по эллиптической орбите, в одном из фокусов которой располагается светило. Степень вытянутости орбиты характеризуется ее
У какой планеты Солнечной системы наибольшее количество спутников и у какой наименьшее?
У какой планеты Солнечной системы наибольшее количество спутников и у какой наименьшее? Рекордсменом Солнечной системы по количеству спутников является гигант Юпитер, у которого 39 известных спутников. Полностью обделила природа в этом отношении Меркурий и
Почему кровь не замерзает в очень холодные дни?
Почему кровь не замерзает в очень холодные дни? Кровь состоит главным образом из воды. Температура замерзания крови очень близка к температуре замерзания воды (0 °C). Наличие в крови белков, соли и других компонентов слегка изменяет эту температуру. Человеческий организм
При какой температуре тела можно умереть?
При какой температуре тела можно умереть? Нормальной обычно считается температура тела не выше 37 °C. Температура ниже 28 °C (при ректальном измерении) может быть опасной для
При какой температуре замерзает вода?
При какой температуре замерзает вода? Чистая вода при О °С не замерзает – как и вода морская.Для того чтобы вода замерзла, ей нужно что-то, к чему могли бы прицепиться ее молекулы. Кристаллы льда формируются вокруг «ядер» – например, частичек пыли. Если же таковых нет,
Выполнение бетонных работ при температуре воздуха выше 25 °C
Выполнение бетонных работ при температуре воздуха выше 25 °C При производстве бетонных работ при температуре воздуха выше 25 °C и влажности менее 50 % следует применять быстротвердеющие портландцементы, марка которых как минимум в 1,5 раза выше марочной прочности бетона.
Когда необходимо вызвать врача при температуре
Когда необходимо вызвать врача при температуре Немедленно обратитесь к врачу, если:– имеются признаки обезвоживания (запавшие глаза, сниженное количество мочеиспусканий или сухие подгузники, запавший родничок у детей до года, отсутствие слез при плаче, сухие слизистые
Что еще сделать при температуре
Что еще сделать при температуре Запасным препаратом является ибупрофен (нурофен, ибуфен). При повышении температуры в период менее 6 часов после дачи парацетамола либо его неэффективности дайте ребенку возрастную дозу ибупрофена. Ибупрофен может даваться не чаще, чем 1
Почему вода в глубоководном озере кажется голубой, а чистая вода из крана – бесцветной?
Почему вода в глубоководном озере кажется голубой, а чистая вода из крана – бесцветной? Солнечный свет, который мы иногда называем белым, содержит в себе все длины волн оптического диапазона – так называемые спектральные цвета – от инфракрасного до ультрафиолетового.


 Состав при снижении температуры охлаждается все больше.
Состав при снижении температуры охлаждается все больше.
